Материалы для специалистов
Введение
Группа детей с детским церебральным параличом (ДЦП) имеет особенности в физическом развитии. Отмечается смещение роста в зону низких величин в подростковом и юношеском возрасте. Дефицит массы тела по отношению к росту чаще встречается во всех возрастных группах, отсутствуют гендерные различия. Белково энергетическая недостаточность усугубляется по мере взросления пациентов с ДЦП. Наибольшая степень мальнутриции выявлена в группе пациентов юношеского возраста. В группе пациентов подросткового и юношеского возраста увеличивается не только процент детей с глубоким дефицитом, но степень дефицита, особенно выраженный у маломобильных пациентов.
В случае спастического поражения с возрастом усугубляются нарушения в функционировании скелетной мускулатуры, что может отражаться и на функции мышц, участвующих в глотании. Тяжесть поражения мускулатуры и мобильность пациентов классифицируется Системой классификации грубых моторных функций (GMFCS; функция ухудшается с уровней I до V). Причем, чем выше уровень по шкале GMFCS, тем грубее нарушения и хуже степень самообслуживания, более выражены явления дисфагии. В неконтролируемо сокращающейся мышечной массе возникают необратимые изменения, отмеченные у пациентов с ДЦП. Изменения в компонентном составе тела пациентов с ДЦП напоминают старческие изменения при саркопении.
Цель оценить уровень провоспалительных цитокинов интерлейкина 6 (ИЛ-6) и фактора некроза опухоли (ФНО) у пациентов со спастическими формами церебрального паралича, выявить взаимосвязь между отдельными показателями компонентного состава тела и способом питания.
Материалы и методы
В исследование вошли 53 пациента (27 мужского пола) с детским церебральным параличом, верифицированным в условиях психоневрологического отделения многопрофильного стационара. Питание через гастростому получали 13 пациентов с дисфагией, остальные ели общий протертый стол. Компонентный состав тела оценен методом биоимпедансометрии, аппарат Диамант Аист мини.
Статистическая обработка материала проводилась с использованием пакета прикладных программ IBM SPSS Statictics 26. Описание количественных данных представлены в виде средневыборочного, стандартного отклонения и 95 %ДИ в формате М ± σ (95 % ДИ) в случае нормального распределения в выборке. В случае распределения отличного от нормального в виде медианы (Ме) и квартилей Q1 и Q3 в формате Ме (Q1-Q3). Гипотеза о нормальности распределения проверялась критерием Шапиро-Уилка. С целью обнаружения различий между выборками использовались критерии Стьюдента или Манна-Уитни. Теснота связи оценивалась с помощью коэффициента корреляции Спирмена. При уровне p < 0,05 результаты считали статистически значимыми.
Результаты
ИЛ-6 является маркером острых системных воспалений. Средние значения уровня ИЛ-6 = 6,74 (5,23 — 8,60), т.е. не превышают референтных значений. Однако, при разделении группы пациентов на получающих питание через гастростому и глотающих пациентов, питающихся протертым столом, выявлены отличия. У пациентов без явлений дисфагии средние значения ИЛ-6 = 6,17 (3,84 — 7,81), не превышали референтных значений. У всех стомированных пациентов с дисфагией, получающих фирменное искусственное питание, уровень ИЛ-6 = 11,39 (37,96 — 19,66), превышал референтные значения в 1,1 раза (1,1 — 1,9), что имело статистически значимое различие (р < 0,001).
Возможно, такое явление свидетельствует о постоянном травматическом / воспалительном поражении тканей в области гастростомы, либо по ходу кишечной трубки.
В среднем уровень ФНО = 3,84 (2,56–5,19), т.е. не превышал референтные значения. При разделении группы обследованных на стомированных и глотающих самостоятельно, в группе глотающих чуть выше уровень ФНО = 4,21 (3,57–6,30), у некоторых пациентов превышал показатель норматив в 2 раза, при этом у стомированных пациентов ФНО = 2,54 (2,39–4,26), и не превышал нормативов.
Выявлены корреляционные взаимосвязи между дефицитом жировой массы и ФНО в группе глотающих самостоятельно (rho = 0,344 р = 0,022, а избытком жировой массы, уровнем безжировой массы и ФНО (rho = 0,345 р = 0,022) в группе стомированных. Значимое отклонение от референтных значений основного обмена в сторону уменьшения выявлено в обеих группах. У глотающих самостоятельно (rho = 0,428 р = 0,004), у стомированных выявлены более сильные взаимосвязи (rho = 0,479 р = 0,001).
Выводы
Выявлен высокий уровень провоспалительных цитокинов ИЛ-6 в группе гастростомированных пациентов, связанный с дефицитом безжировой массы и нарастанием жировой составляющей компонентного состава тела. Уровень ФНО в основном не превышал референтных значений, также имел значимые связи межу значением ФНО и компонентным составом тела, а частности с долей жировой массы и безжировой составляющей. Прирост жировой массы и утрата безжировой массы, сопровождающийся нарастанием провоспалительных цитокинов может свидетельствовать о развитии саркопении у этих пациентов. ФНО имел прямые корреляционные связи с отклонением основного обмена от его нормы.
Источник: ВЫСОКИЙ УРОВЕНЬ ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ ВЫЯВЛЕН У ГАСТРОСТОМИРОВАННЫХ ПАЦИЕНТОВ С ДЕТСКИМ ЦЕРЕБРАЛЬНЫМ ПАРАЛИЧОМ.
Завьялова А. Н., Новикова В. П., Прудникова М. Д., Аль-Харес М. Мт., Гавщук М.В., Гурина
О. П., Блинов А. Е., Варламова О.Н.
В КЦДПН физическая реабилитация представлена широким спектром физических методов воздействия и подбирается с учетом поставленной SMART – цели ребенка. Очень важно также, что физические методы лечения подбирают в зависимости от возраста, ведущего патологического симптома в двигательной сфере, степени двигательных нарушений (уровень по GMFCS), наличия осложнений основного патологического состояния (например, эпилептических приступов или вторичных скелетных деформаций) и наличия сопутствующих заболеваний (например, врожденного порока сердца или гемофилии).
В нашем центре представлены разнообразные методики физической реабилитации:
- Позиционирование с использованием специализированных опор для сидения, вертикализирующих устройств различных модификаций, туторов, ортезов, универсальные ортопедические системы, ходунков и т.д.
- Кинезиотерапия (упражнения, направленные на улучшение показателей кардиореспираторной выносливости, мышечной силы, равновесия, гибкости).
- Механотерапия
- Роботизированная механотерапия.
- Метод динамической проприоцептивной коррекции.
- Функциональная программируемая электростимуляция мышц в ходьбе.
- Гидрокинезиотерапия
Метод лечения положением – пассивное удержание частей тела пациента с церебральным параличом в позах, близких к физиологическим с помощью специальных приспособлений: укладок, подушек, шин, ортезов, гипсовых лангет, тейпов, ортопедической обуви. Принудительной фиксации какой-либо части тела обычно предшествует массаж с применением расслабляющих приемов. Для глобального изменения позы тела пациента с выраженными парезами применяют специальное оборудование: вертикализаторы, тренажер Гросса, позволяющие ребенку, с уменьшенной нагрузкой на опорно-двигательный аппарат, сохранять вертикальное или подвешенное положение, тренируя опору, шаговые движения, координацию при помощи инструктора.
Кинезиотерапия – лечение движением, предполагает адаптированные, постепенно возрастающие силовые воздействия, определённые строго индивидуально для каждого пациента, с учётом его анамнеза, возрастных, физиологических и других особенностей и других заболеваний, сопутствующих основному. Постепенное обучение правильным (простым и сложным) движениям приводит к их нейрорефлекторному закреплению и восстановлению трофики и обмена веществ в костно-мышечной системе человека.
Кинезиотерапия может быть активной (лечебная физкультура, лечение положением, игротерапия, трудотерапия, арт-терапия, спорт, когда пациент двигается сам) и пассивной (массаж и механотерапия, то есть лечение физическими упражнениями с помощью специальных аппаратов).
Механотерапия (вариант пассивной кинезиотерапии). Данный метод физической реабилитации заключается в последовательном выполнении дозированных упражнений на приборах и механизмах, сконструированных особым образом в направлении целевого развития отдельных групп мышц и суставов.
По целевому назначению выделяются следующие категории механотерапевтических приборов:
- аппараты диагностирующие с биологической обратной связью, которые позволяют с большой точностью оценить эффективность восстановления двигательной функции и качество движений (динамометры, угломеры, гониометры и т.д.);
- аппараты фиксирующие и поддерживающие, которые дают возможность выделить отдельные фазы движений (блочные установки для структуризации двигательных актов в отдельных суставах); тренажеры, дозирующие физические нагрузки при выполнении упражнений (беговая дорожка, велотренажер и т.д.);
- аппараты комбинированного типа, которые формируют целостные комплексы двигательных действий.
По характеру выполняемых движений различают также аппараты активного и пассивного действия. В первом случае пациент осуществляет движения прилагая собственные физические усилия. Степень нагрузки регулируют с помощью целого ряда факторов: веса прикрепленного груза, его местоположения на штанге, угла, под которым подвешен маятник, частоты колебаний и длительности занятия (например, мультифункциональная тренировочная система MOTOmed). Аппараты преимущественно пассивного действия предполагают выполнение движений с помощью моторного устройства, которое облегчает физическую нагрузку на пациента (например, реабилитационный комплекс для локомоторной нагрузки системы Locomat). Следует всегда помнить, что механотерапевтический аппарат, сколь совершенным бы он ни был, все же не способен с абсолютной точностью воспроизводить двигательные функции человека во всем их многообразии. Упражнения на механизмах носят строго нормализованный характер, выполняются по заранее заданной схеме, с определенной скоростью, амплитудой и нагрузкой. При этом в комплексе с механотерапией лечебная гимнастика показывает существенно более высокую результативность, нежели без нее.
Метод динамической проприоцептивной коррекции. В основе данного метода лежит сочетание принципа лечения положением с активной кинезиотерапией. Лечебные костюмы «Адели» представляют собой систему эластичных тяг, которая по своему расположению соответствует расположению мышц-антагонистов (сгибателей и разгибателей), а также мышц, участвующих в ротационных и других движениях. Кроме того, предусматриваются специальные тяги, способные обеспечить коррекцию положения стопы, разведение плечевого пояса и выполнение других функций, а также ряд специальных приспособлений, связанных с индивидуальной спецификой биомеханики движений больных. Более современные пневмо-костюмы «Фаэтон» осуществляют свою каркасную и антигравитационную функцию за счет поддува сжатого воздуха, который инструктор индивидуально дозирует для каждого пациента. Нагрузочный костюм действует как эластичный внешний каркас, не ограничивая амплитуду движения, а лишь утяжеляя с лечебной целью их выполнение. Суть метода динамической проприоцептивной коррекции с использованием лечебных костюмов заключается в восстановлении с помощью лечебного костюма нарушенных функций двигательного центра головного мозга путем направленной коррекции позы и движений. Это приводит к разрушению сложившихся патологических синергий и становлению новых нормализованных рефлекторных связей, что и оказывает соответствующее нормализующее действие на структуры центральной нервной системы, контролирующие движения и речь.
При реабилитации пациентов с ДЦП широко используются физиотерапевтические методы, в том числе основанные на природных факторах воздействия: аппликации грязей, парафина, озокерита с антиспастической целью, электрофизиологические методы лечения, гидротерапия.
Функционально программируемая электростимуляция мышц в ходьбе применяется для восстановления (становления) биомеханики ходьбы, улучшение повседневной двигательной активности у пациентов с мышечным дефицитом.
В центре проводится комплексная реабилитация с применением ФПЭС в ходьбе по нескольким схемам:
- Отсроченная послеоперационная реабилитация (3-6 месяцев);
- После ботулинотерапии;
- В рамках консервативной терапии.
Пациенты с I, II, III уровнем функционирования по шкале глобальных моторных функций провидится ФПЭС по следующим методикам:
- 3х канальная ЭС, включающая ЭС большой и средней ягодичных мышц, четырехглавой мышцы бедра, передней большеберцовой мышцы;
- 4х канальная ЭС, включающая ЭС большой и средней ягодичных мышц, четырехглавой мышцы бедра, полусухожильной мышцы и двуглавой мышцы бедра, передней большеберцовой мышцы;
- 2х канальная ЭС, включающая ЭС большой и средней ягодичных мышц, передней большеберцовой мышцы.
Преимущества ФПЭС в ходьбе:
- Улучшение функции ослабленных мышц;
- Коррекция неправильно выполняемых движений;
- Выработка и поддержание двигательного стереотипа ходьбы.
Гидрокинезиотерапия занимает одно из ведущих мест в комплексной реабилитации пациентов с тяжелыми двигательными нарушениями, в том числе с церебральным параличом. Упражнения, выполняемые в водной среде по эффективности в несколько раз, превосходят занятия «на суше».
Физические упражнения в воде (гимнастика в воде, плавание, игры в воде) являются одной из форм двигательной реабилитации. Целью методики является повышение возможности физического, двигательного и психомоторного развития детей с двигательными нарушениями, улучшение кровообращения и трофики, укрепление связочного аппарата, ослабление мышечной дистонии, снижение нагрузки на мышцы и тренировка их в облегченных условиях, эффективная и безболезненная разработка мышечных контрактур или профилактика их возникновения, улучшение опороспособности, баланса, ручных манипуляций, усовершенствование движений и координации. На базе Центра в отделении бальнеологического лечения занятия гидрореабилитацией проводятся в оборудованных бассейнах (большая и малая ванны), оснащенных гидравлическими подъемниками для спуска и подъема в воду, а также лестницами с поручнями. В работе используется специальное приспособление: тренажер «Гросса», а также плавательные доски, нарукавники, нудлы, круги и др. В комплексной программе медицинской реабилитации детей с двигательными нарушениями в процессе гидрореабилитации используются специализированные ортезы, изготовленные индивидуально на пораженную конечность. Также используется терапия с ограничением (плавание стилем «брасс» с фиксацией здоровой руки в лонгете на доску), бимануальная терапия (например, упражнение бросания мяча в корзину на воде).
Подготовила врач ФРМ Красильникова К.П.
Детский церебральный паралич (ДЦП) сохраняет лидирующие позиции в структуре детской инвалидности и социальной дезадаптации детей-инвалидов. Учитывая потенциально высокую способность коры головного мозга ребенка к спонтанной или индуцированной реорганизации нейронных сетей, частичное восстановление нарушенных функций при ДЦП является хотя и сложной, но вполне реальной задачей. В последние годы в реабилитационном лечении детей с ДЦП все чаще применяется терапия с использованием различных видов роботизированной техники и технологий, основанных на принципе формирования внешней цепи биологической обратной связи (БОС).
Так, в основе инновационной методики восстановительного лечения «неинвазивный интерфейс “мозг – компьютер”» (НИМК) лежит теория создания устойчивых связей между неповрежденными участками мозга при помощи роботизированных устройств, компенсирующих нарушенные моторные и сенсорные функции организма ребенка-инвалида.
Ранее авторами была показана высокая клиническая эффективность применения комбинированной методики «НИМК – экзоскелет кисти» в реабилитации детей с ДЦП, которую
характеризовали по возможности выполнения навыков самообслуживания, силе мышц верхних конечностей, уровню спастичности, динамике работоспособности, устойчивости внимания с помощью специализированных оценочных шкал.
Получив значимый положительный результат в предшествующих работах применения комбинированной методики «НИМК – экзоскелет кисти» в реабилитации детей с ДЦП, выразившийся в увеличении силы мышц верхних конечностей, повышении работоспособности, улучшении бытовых навыков и устойчивости внимания, поставили задачу определения возможного механизма обеспечения данного процесса. Необходимо подчеркнуть, что все пациенты достаточно длительное время жили с существующим сформировавшимся стабильным неврологическим дефицитом. Авторы выдвинули гипотезу, что целенаправленная физическая, когнитивная и эмоциональная активность детей при проведении процедур, а также активная и, как правило, бурная поддержка их родственников формируют аналог острого стресса в головном мозге, приводящего к активизации процессов нейропластичности. Доказательством данной гипотезы, могло явиться изменение уровня активности нейротрофических факторов (НТФ).
Поскольку содержание НТФ в периферической крови прямо коррелирует с их уровнем в ЦНС, этот факт можно рассматривать в качестве биомаркера процессов нейропластичности и нейрогенеза, синаптогенеза, а также как показатель эффективности ответа на проводимую терапию.
Целью данного исследования являлось изучение динамики концентрации НТФ (фактора роста головного мозга – BDNF; нейротрофинов 3 и 4/5 – NT3 и NT4/5; факторов роста фибробластов – FGF1 и FGF2) в крови детей с ДЦП при восстановительном лечении с применением программно-аппаратного комплекса «НИМК – “Экзокисть-2”», а также оценка возможности использования значений концентрации НТФ как маркеров эффективности реабилитационного лечения.
Пациенты и методы. Клинико-лабораторное исследование проводилось на базе Крымского федерального университета им. В.И. Вернадского (поликлиническое отделение Клинического медицинского многопрофильного центра Святителя Луки и центральная научно-исследовательская лаборатория Медицинской академии им. С.И. Георгиевского) в соответствии с протоколом, рассмотренным и одобренным комитетом по биоэтике. Обследован 151 пациент мужского и женского пола в возрасте от 12 до 18 лет (средний возраст – 14,5±1,4 года) с диагнозом ДЦП.
Перед началом исследования все пациенты прошли неврологический осмотр. В структуре неврологических нарушений у пациентов был выявлен геми- или тетрапарез, в ряде случаев в сочетании с гиперкинетическим или атактическим синдромами, с уровнем двигательной активности по критериям классификации больших моторных функций (Gross Motor Function Classification System for Cerebral Palsy, GMFCS) не выше III. Двигательную функцию оценивали с использованием следующих неврологических шкал: Модифицированная шкала спастичности Эшворт (Modified Ashworth Scale for Grading Spasticity, MASGS; оценка степени тяжести и частоты сопротивления пассивным движениям по 5-балльной шкале); Модифицированная шкала Тардье (Modified Tardieu Scale, MTS; 5-уровневая оценка мышечного сопротивления при быстром и медленном пассивном движении); Шкала оценки мышечной силы Британского совета медицинских исследований. Для шкал Эшворта, Тардье и Шкалы оценки мышечной силы учитывались только показатели кисти (средние по сгибателям и разгибателям в лучезапястном суставе). Способность выполнять бытовые навыки оценивалась при помощи Модифицированной шкалы Френчай (Modified Franchay Scale, MFS; оценка в баллах двигательной функции в виде возможности выполнения ежедневных обиходных действий) и с использованием теста ABILHAND-Kids (оценка родителями двигательной функции руки ребенка в быту, которая состоит из трех граф по степени возможности выполнения навыка: «невозможно», «трудно», «легко»).
Для восстановительного лечения двигательной функции руки применялся программно-аппаратный комплекс «НИМК – “Экзокисть-2”», производителем которого является консорциум в составе: НПО «Андроидная техника», РНИМУ им. Н.И. Пирогова и Институт высшей нервной деятельности и нейрофизиологии РАН. Использованная система неинвазивного нейроинтерфейса основана на программном анализе изменений паттерна электроэнцефалограммы, возникающих при представлении движения руки (разгибание кисти). Пациент проходил 10 занятий по унифицированной схеме: одно занятие в день из трех сессий по 10 мин с перерывом на отдых не менее 5 мин. Пациент находился в кресле на расстоянии 1 м от экрана монитора, на который подавались визуальные команды на воображение движений левой или правой руки или расслабление. В течение занятия каждая из ситуаций продолжительностью по 10 с повторялась 24 раза. При точном выполнении пациентом задания фиксирующая взор белая метка окрашивалась в зеленый цвет и перчатка экзоскелета выполняла пассивное разгибание кисти; при недостаточном воображении движения метка оставалась белой и экзоскелет не срабатывал. Динамику восстановления двигательных функций руки характеризовали по указанным выше неврологическим шкалам на 10-й день после завершения процедуры реабилитации.
Все обследованные пациенты были разделены на четыре группы в зависимости от применяемых методик реабилитационного лечения. Программа реабилитационного лечения в 1-й группе (n=52) включала стандартный курс реабилитационного лечения (лечебную физкультуру, массаж паретичных конечностей, электростимуляцию антагонистов спастичных мышц) в сочетании с использованием тренировок на программно-аппаратном комплексе «НИМК – “Экзокисть-2”». Пациенты 2-й группы (n=35) дополнительно получали ноотропный пептидергический препарат Церебролизин® в виде внутримышечных инъекций по 2 мл ежедневно в течение 10 дней за 40 мин до тренировок на НИМК. Третью группу составили 39 детей-инвалидов, у которых в программу восстановительного лечения входил стандартный курс реабилитации в сочетании с тренировками на программно-аппаратном комплексе «НИМК – “Экзокисть-2”», внутримышечными инъекциями препарата Церебролизин® и ботулинотерапией в спастичные мышцы кисти. В группу сравнения вошли 25 детей с диагнозом ДЦП, получавшие курс стандартного реабилитационного лечения. Ограничением данного исследования служит отсутствие рандомизации при формировании групп пациентов.
Непосредственно перед началом процедуры реабилитации с применением программно-аппаратного комплекса «НИМК – “Экзокисть-2”» и на 10-й день после ее завершения от каждого пациента получали образцы венозной крови, стабилизированной K3-EDTA. Плазму крови отделяли центрифугированием при 1000 g в течение 10 мин и хранили в низкотемпературной морозильной камере (-70 °С) не более 2 мес. Концентрацию НТФ в образцах плазмы крови пациентов определяли методом иммуноферментного анализа с помощью набора реагентов SEA011Hu (Enzymelinked immunosorbent Assay Kit For Brain Derived Neurotrophic Factor) компании Cloud-Clone Corp. (США) в соответствии с инструкцией производителя.
Результаты. В результате клинического обследования пациентов с ДЦП, проведенного на 10-й день после курса восстановительного лечения, было установлено, что в 1–3-й группах, в программе реабилитации которых использовался программно-аппаратный комплекс «НИМК – “Экзо- кисть-2”», значимо уменьшилась спастичность и увеличилась сила мышц кисти. В то же время у детей с ДЦП, отнесенных к группе сравнения, значимых изменений по этим показателям не выявлено. Проведенный анализ возможности выполнения повседневных навыков показал, что у всех пациентов с ДЦП из 1–3-й групп после окончания курса реабилитации зарегистрировано значимое увеличение объема бытовых навыков, оцениваемых при помощи теста ABILHANDKids.
Авторы просили также родителей пациентов с ДЦП описать их собственную оценку результатов реабилитации, акцентируя внимание на возможности самообслуживания и уменьшении зависимости от окружающих. Родителями подчеркивалось, что пациенты продемонстрировали (причем многие из них – впервые в жизни) возможность самостоятельно одеваться, застегивать молнию, принимать пищу, умываться. Увеличение объема бытовых навыков, возможностей самообслуживания и уменьшение зависимости от окружающих в повседневной жизни наиболее важным результатом проведенного курса реабилитации. Некоторые пациенты впервые в жизни смогли удержать в руке карандаш и нарисовать картинку и написать буквы. У детей с ДЦП из группы сравнения также отмечена четкая тенденция к расширению объема выполняемых бытовых навыков, однако наблюдаемые изменения были статистически незначимыми.
Заключение. Таким образом, успешная реабилитации детей с ДЦП с применением программно-аппаратного комплекса «НИМК – “Экзокисть-2”» тесно ассоциирована с выраженным уменьшением концентрации НТФ в периферической крови на 10-й день после завершения реабилитационного лечения, что может быть использовано в качестве предиктора эффективности данного варианта БОС-терапии. Полученные результаты взаимоотношения изменений концентрации различных НТФ в крови параллельно со значимой, подтвержденной клиническим обследованием и родителями пациентов с ДЦП, положительной динамикой двигательной функции кисти могут рассматриваться как доказательство участия НТФ в механизмах восстановительного лечения.
Источник: Роль нейротрофических факторов в процессе реабилитации детей с детским церебральным параличом.
Ларина Н.В., Гордиенко А.И., Корсунская Л.Л., Химич Н.В.
Неврология, нейропсихиатрия, психосоматика. 2022;14(6):12–19.
В статье приведены данные о 50 новорожденных, с гипоксическим поражением ЦНС в неонатальном периоде госпитализированных и амбулаторно лечившихся в отделении неонотологии областного детского многопрофильного медицинского г. Самарканда с 2021 по 2022 год. Всем обследуемым новорожденным и их матерям проведена оценка акушерского анамнеза, пери- и постнатального периода развития детей. Проводилась оценка физического развития, ЦНС, и клинического статуса, включавшего данные объективного осмотра.
Введение
В настоящее время перинатальное поражение центральной нервной системы новорожденных занимают важное место в структуре патологии детей раннего возраста, что связано с высокой распространенностью, тяжестью клинических проявлений и риском формирования инвалидности. Вне зависимости от этиологии гипоксии, патологическое действие ее на плод развивается по одному сценарию и сопровождается разной степени нарушением развития, созревания мозга, провоцируя возникновение гипоксически-ишемической энцефалопатии в постнатальном периоде. Высокая частота тяжелой сочетанной перинатальной патологии у данной категории детей обусловила рост детской инвалидности, в структуре которой ведущие позиции (21,2%) принадлежат патологии нервной системы и органов чувств. Среди этиологических факторов, наиболее значимых в патогенезе перинатальных церебральных повреждений, лидирующая роль принадлежит гипоксии. В связи с этим, изучение факторов риска и особенностей перинатального поражения центральной нервной системы у новорожденных без сомнения является актуальным.
Материал и методы
Под наблюдением находилось 50 новорожденных, госпитализированных и амбулаторно лечившихся в отделении неонотологии областного детского многопрофильного медицинского г. Самарканда с 2021 по 2022 год. Все дети были распределены на 2 группы: первая группа -15 новорожденных, с перинатальным поражением ЦНС гипоксического генеза, вторая группа — 35 новорожденных с перинатальным поражением ЦНС без гипоксического генеза. Возраст детей составил от 5 дней до 28. Всем обследуемым новорожденным и их матерям проведена оценка акушерского анамнеза, пери- и постнатального периода развития детей. Проводилась оценка физического развития, ЦНС, и клинического статуса, включавшего данные объективного осмотра. Также анализировалась заболеваемость на 28 дней жизни.
Результаты исследования
Структура новорожденных с гипоксическим поражением центральной нервной системы I группы составила – 57%. Вентрикуломегалия наблюдалась в – 78 % случаев. Среди новорожденных II группы данная патология не наблюдалась. Анализ акушерского анамнеза матерей обследуемых детей выявил, что анемия в целом встречалась у женщин со средним возрастом – 28 года. Среднее количество беременностей у матерей детей с гипоксическим поражением центральной нервной системы составляло 3,3, количество родов – 3. Выявлено отсутствие достоверных различий по анализируемым показателям в обследуемых группах.
Однако, отмечалась тенденция к увеличению возраста и количества беременностей у женщин I группы. При анализе антенатального периода выявлено, что в целом осложненное течение беременности наблюдалось более чем у половины матерей (53%). Беременность на фоне анемии (средний и тяжѐлой степени) и гестоз наблюдались у трети женщин (30 %). Различий в течении антенатального периода в I и II группах выявлено не было.
Анализ интранатального периода показал, что у 2/3 матерей роды были срочными (68 %). Три четверти детей (74 %,) имели массу тела более 2 500 г и срок гестации при рождении больше 37 недель. Недоношенные дети имелись и в I и во II группах. Различия по срокам родоразрешения и сроком гестации между группами отсутствовали. Все доношенные дети с гипоксическим поражением центральной нервной системы имели массу тела 3350,0±580,4 г, недоношенные – 2030,0±320,3 г, длину тела 51,0±3,5 см и 46,0±4,5 см соответственно. Отличия в антропометрических показателях между группами выявлены не были. При оценке шкалы Апгар на 1-й минуте средний балл в целом для детей с ВПС составил 6 на 5-й минуте – 7 баллов. Отличий в группах наблюдения выявлено не было. Отсутствие признаков гипоксии (по шкале Апгар 7–10 баллов) на 1–й минуте имела только половина детей (45 %), на 5-й минуте – 2/3 обследуемых (74 %). Установлено, что на 1-й минуте жизни у детей I группы достоверно чаще встречались признаки гипоксии (шкала Апгар 4–6 баллов) в сравнении с детьми II группы: 84%, и 30,0%, соответственно, на 5-й минуте признаки гипоксии наблюдались у практически равного количества детей I и II групп (34%, и 20,0%), соответственно.
Выводы
Отягощенный акушерский анамнез у матерей (искусственное прерывание беременности и привычное не вынашивание) увеличивал риск возникновения гипоксии на 1 неделе жизни в 4,7 раз. У 56% детей с гипоксическим поражением центральной нервной системы, родившихся от матерей с отягощенным акушерским анамнезом, тяжесть анемии изолированно была связана с влиянием отягощенного акушерского анамнеза их матерей.
Таким образом, беременные женщины с анемией должны относиться к группе риска по рождению детей с гипоксическим поражением центральной нервной системы, на 1-ой неделе жизни, и находиться под пристальным вниманием акушеров-гинекологов с целью более раннего антенатального выявления гипоксическим поражением центральной нервной системы у вынашиваемых плодов.
Источник: СОМАТИЧЕСКИЙ СТАТУС НОВОРОЖДЕННЫХ С ГИПОКСИЧЕСКИМ ПОРАЖЕНИЕМ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
Хиромон Н.С., Азиза А. А., Дилдора Б. Б.
Academic research in educational sciences. 2023. №1
Представлена коррекционно-развивающая программа для детей 5–7 лет с ограниченными возможностями здоровья, включающая занятия с использованием телесных практик, сенсорной интеграции, компьютерного стабилографического комплекса и ароматерапии. Определено, что применение разработанной программы позволяет ребенку прочувствовать свое тело, восстановить психоэмоциональное состояние, повысить концентрацию внимания.
Введение
В настоящее время на территории Российской Федерации по статистике проживает порядка двух миллионов детей с ограниченными возможностями здоровья (ОВЗ). При этом стоит отметить, что термин «дети с ОВЗ» не представляет собой синоним понятия «дети-инвалиды». Дети с ограниченными возможностями здоровья не всегда являются инвалидами, хотя эти два понятия между собой связаны и пересекаются.
Дети с ОВЗ – это отдельная категория детей, которые не имеют группу инвалидности, но при этом у них имеются определенные зафиксированные нарушения физического или умственного развития, которые выступают как препятствие нормальной жизнедеятельности и социализации. Данные ограничения могут касаться как физиологических, сенсорных, так и психологических возможностей ребенка. Категория детей с ОВЗ очень разнообразна: к ней причисляют детей с нарушением слуха, зрения, речи, опорно-двигательного аппарата, задержкой психического развития, умственной отсталостью и расстройствами аутистического спектра, синдромом дефицита внимания, повышенной утомляемостью и двигательной расторможенностью.
Как правило, данная категория детей посещает общие дошкольные образовательные учреждения, при этом дальнейшее их обучение будет проводиться в общеобразовательных школах совместно со здоровыми сверстниками. В обучении дети с ОВЗ нуждаются в особых подходах, им необходимо уделять больше внимания, для них не подходят общепринятые методики и классические методы обучения, а имеющиеся отклонения могут оказать значительное влияние на состояние здоровья, успеваемость, социализацию и адаптацию в школе.
Цель исследования – рассмотреть влияние нетрадиционных средств коррекции: телесных практик, сенсорной интеграции, занятий с использованием компьютерного стабилографического комплекса и ароматерапии на психофизическое состояние ребенка с ОВЗ.
Для достижения цели были поставлены следующие задачи исследования:
1) рассмотреть особенности познавательной сферы и двигательной памяти детей 5–7 лет, имеющих отклонения в состоянии здоровья;
2) разработать программу коррекционно-развивающих занятий для детей 5–7 лет с ОВЗ, посещающих дошкольные образовательные учреждения;
3) экспериментально проверить эффективность программы коррекционно-развивающих занятий для данного контингента.
Методика и организация исследования
Для диагностики позна-вательной сферы детей 5–7 лет использовались такие диагностические методики, как «Запоминание 10 слов» (А.Р. Лурия), «Найди отличия» (О.Н. Земцова), «Разрезные картинки» (С.Д. Забрамная), «Какие предметы спрятаны в рисунках» (Р.С. Немов), «Доска Сегена» и др.
С целью коррекции, развития и подготовки к предстоящему обучению в общеобразовательных школах была разработана программа коррекционно-развивающих занятий для детей 5–7 лет с ОВЗ, посещающих дошкольные образовательные учреждения, которая предусматривает апробацию новых подходов к организации образовательной деятельности детей с ОВЗ в рамках обучения в дошкольных образовательных учреждениях. Программа комплексного коррекционно-развивающего сопровождения включала два этапа – основной и дополнительный.
Основному этапу предшествовала диагностика функционального и психологического состояния детей, которая позволила получить представление о состоянии ребенка и далее сформировать однородные группы для последующих занятий.
В рамках основного этапа ребенку предлагаются оздоровительные занятия с использованием телесных практик и сенсорной интеграции, которые предоставляют возможность прочувствовать свое тело, восстановить психоэмоциональное состояние, научить головной мозг правильно обрабатывать информацию, полученную от органов чувств, улучшить навыки речи, концентрацию внимания, стимулировать развитие памяти и понимание.
Занятия на компьютерном стабилографическом комплексе проводятся индивидуально с каждым ребенком, у которого по результатам диагностики отмечены показатели ниже среднего. Проведение блока занятий на компьютерном стабилографическом комплексе осуществляется совместно с акупунктурным аромамассажем терапевтическими маслами, которые были подобраны заранее в процессе ароматестирования.
После завершения основного этапа было проведено повторное тестирование, которое позволило отследить динамику ряда показателей и дать промежуточную оценку эффективности программы.
На дополнительный курс оздоровительных занятий с использованием телесных практик и сенсорной интеграции приглашаются дети, у которых, по происшествии нескольких месяцев без занятий, тестируемые показатели снизились с 10 до 30 %. Тем детям, у которых показатели снизились более чем на 30 %, предлагаются оздоровительные занятия с использованием телесных практик, сенсорной интеграции и компьютерного стабилографического анализатора.
Результаты исследования и их обсуждения
Разработанная программа коррекционно-развивающих занятий была ориентирована на развитие двигательной активности детей с ОВЗ, совершенствование физических качеств, а также на устранение дефицитарности структур головного мозга, обеспечивающих базу для развития высших психических функций, для дальнейшего беспрепятственного обучения в образовательных учреждениях наравне с физически здоровыми детьми.
Структурными компонентами программы коррекционно-развивающих занятий являются: диагностика функционального и психологического состояния, занятия с использованием телесных практик и сенсорной интеграции, занятия с использованием компьютерного стабилографического комплекса и ароматерапии.
Телесные практики представляют собой метод психологической коррекции личности через работу c телом человека. Путем выполнения элементов из телесно-ориентированной терапии ребенок учится управлять своим телом, взаимодействовать c окружающими, правильно выражать свои и чувствовать эмоции других людей.
Проведение занятий с включением упражнений и заданий, ориентированных на развитие сенсорной системы, способствуют тому, что головной мозг получает нужные знания об окружающей обстановке и внешних стимулах, воздействующих на системы человека (зрительную, слуховую, вестибулярную и т. д.).
При занятиях на «Стабилане-01» детям необходимо было выполнять точные и плавные по своей структуре движения, за счет которых происходит обогащение афферентного потока восходящих нервных импульсов сигналами от мышц, связок и суставов, что проявляется новыми двигательными навыками и, как следствие, происходит выработка новых, не патологических, двигательных стереотипов движений. Применение обратной сигнализации помогает ребенку «найти» сенсомоторное ощущение правильного движения, которое закрепляется в повторных движениях и постепенно доводится до полного двигательного автоматизма. При этом происходит четкий визуальный контроль сигнала обратной связи уровня двигательной активности, который обеспечивается специализированной аппаратурой, что позволяет в значительной мере повысить информационную значимость поступающей двигательной афферентации в мозг.
Еще одним компонентом программы является массаж с использованием масел. В ряде исследований определена эффективность использования летучих фракций эфирных масел в качестве фитоадаптогенов. Основываясь на данном свойстве, можно применять эфирные масла в педиатрии в комплексе лечебно-профилактических мероприятий. Использование эфирных масел при проведении массажа способствует стимуляции неспецифической защиты, иммунологической реактивности, а также снятию эмоционального стресса. При воздействии массажных приемов на рецепторы кожи и мышц возникают импульсы, которые, достигая коры головного мозга, оказывают тонизирующее воздействие на центральную нервную систему, в результате чего повышается ее регулирующая роль в отношении всех систем и органов. Прикосновение к ребенку стимулирует рост чувствительных нервных окончаний на теле, включаясь в движение, пространственную ориентацию и сенсорное восприятие.
Предварительное исследование показало снижение объема памяти у детей, недостаточную быстроту и прочность запоминания, устойчивость внимания характеризовалась как сниженная в силу частых отвлечений. При этом достаточно у многих детей отмечались затруднения при выполнении инструкции, состоящей из нескольких этапов. Также стоит отметить, что при исследовании восприятия были выявлены затруднения интерпретации информации, что, скорее всего, связано с недостаточностью знаний и опыта. Навыки мыслительной деятельности малоустойчивые, слабо выражена способность к построению и установлению элементарных умозаключений.
После реализации программы была отмечена положительная динамика по всем исследуемым показателям, почти в два раза. К концу эксперимента большинство детей начали осознавать воспринимаемый объект, образы восприятия в соответствии со своими знаниями и опытом, стали быстрее интерпретировать. При частичном зрительном анализе и практическом промеривании начали собирать целостное изображение.
Объем памяти можно оценить как достаточный, – к концу эксперимента дети стали воспроизводить 5–7 слов, тогда как в начале исследования – не более 3–4 слов. В процессе выполнения заданий снизилось количество отвлечений, отмечалась достаточная концентрация и переключаемость внимания. К концу эксперимента навыки мыслительной деятельности стали достаточно устойчивые, при этом предложенную помощь начинали использовать продуктивно.
С помощью компьютерного стабилоанализатора «Стабилан-01» была проведена оценка объема двигательной памяти (тест «Треугольник»). Полученные результаты позволяют считать, что высшие отделы головного мозга готовы к формированию образа двигательного действия. Был проведен анализ времени выполнения движения по первоначально заданной траектории, которое на момент начала исследования на этапе повторного воспроизведения превысило в 2,7 раза первоначальное воспроизведение заданной фигуры. После проведенных занятий по программе показатели воспроизведения заданного треугольника существенно изменились. Так, различия времени прохождения фигуры на этапах обучения и анализа составили 0,5 раза. Положительная динамика времени воспроизведения заданной фигуры дает основание полагать, что под влиянием предложенных занятий наблюдается перестройка функциональных свойств и связей нейронных сетей головного мозга ребенка. Такая перестройка обеспечивает адаптивное изменение поведения благодаря сохранению памяти о приобретенном опыте.
Заключение
По результатам экспериментальной проверки эффективности программы коррекционно-развивающих занятий для детей 5–7 лет с ОВЗ можно судить о том, что происходит более быстрое и качественное усвоение сложно-координационных двигательных действий, а также отмечается положительная динамика по всем исследуемым показателям познавательной сферы детей.
Источник: ОСОБЕННОСТИ КОРРЕКЦИОННО-РАЗВИВАЮЩИХ ЗАНЯТИЙ ДЛЯ ДЕТЕЙ С ОГРАНИЧЕННЫМИ ВОЗМОЖНОСТЯМИ ЗДОРОВЬЯ
Р.Р. Швец, Н.Ю. Токмакова
Известия ТулГУ. Физическая культура. Спорт. 2023. Вып. 1
Введение
Нутритивный статус пациентов с церебральным параличом (ДЦП) отличается от такового у типично развивающихся детей, и претерпевает изменения в процессе взросления. Оценить висцеральный пул белка, одну из составляющих нутритивного статуса, можно лабораторными методами. Рутинные показатели не всегда отражают истинную картину глобальных изменений в организме. Наиболее интересны ранее не изученные у этой категории пациентов белки с высокой скоростью синтеза, отвечающие за васкулогенез, участвующие в работе мышц, белки — маркеры воспаления.
Цель исследования: оценить уровень VE GF-A (васкулоэндотелиалиаотного фактора роста), тропонина I, ферритина у пациентов со спастическими формами ДЦП, выявить взаимосвязь между отдельными показателями компонентного состава тела и способом питания.
Материалы и методы
В исследование вошли 53 пациента (27 мужского пола) с ДЦП, верифицированным в условиях психоневрологического отделения многопрофильного стационара. Питание через гастростому получали 13 пациентов с дисфагией, остальные ели общий протертый стол. Компонентный состав тела оценен методом биоимпедансометрии, аппарат Диамант Аист мини. Статистическая обработка материала проводилась с использованием пакета прикладных программ IBM SPSS Statictics 26.
Описание количественных данных представлены в виде средневыборочного, стадартного отклонения и 95 %ДИ в формате М ± σ (95 % ДИ) в случае нормального распределения в выборке. В случае распределения отличного от нормального в виде медианы (Ме) и квартилей Q1 и Q3 в формате Ме (Q1-Q3). Гипотеза о нормальности распределения проверялась критерием Шапиро-Уилка.
С целью обнаружения различий между выборками использовались критерии Стьюдента или Манна-Уитни. Теснота связи оценивалась с помощью коэффициента корреляции Спирмена. При уровне p < 0,05 результаты считали статистически значимыми.
Результаты
Сосудистый фактор проницаемости VE GF-A усиливает и увеличивает проницаемость микрососудов, служит частью системы, отвечающей за восстановление подачи кислорода к тканям в ситуации, когда циркуляция крови недостаточна, как у пациентов со спастическим тетрапарезом. Средние значения VE GF-A = 66,13 (33,42 — 92,64), при этом, у пациентов без дисфагии VE GF-A = 49,50 (23,94–91,57), превышение этого показателя у ряда пациентов не значительное, в 1,2 раза (1,0–2,1). У пациентов с дисфагией, длительно питающихся специализированными фирменными смесями для энтерального питания в гастростому средний уровень VE GF-A = 71,96 (45,24 — 87,13) и превышение VE GF-A в 1,5 раза (1,0 — 2,0). Значимых различий между группами по этому показателю не выявлено. В компонентном составе тела выявлены корреляционные связи между долей активной клеточной массы и VE GF-A у пациентов без дисфагии (rho = -0,378 р = 0,016), у больных с дисфагией VE GF-A и долей безжировой массой в процентах (rho = -0,326 р = 0,040) и уровнем общей воды в организме (rho = -0,373 р = 0,018).
Уровень тропонина I и ферритина, определенных качественным методом, не превышал референтных значений в обеих группах. Повышение VE GF-A свидетельствует о нарушении эндотелиальной дисфункции предиктор сердечно- сосудистой патологии в будущем.
Выводы
Фактор сосудистого воспаления VE GF-A в пределах референтных значений или чуть превышает их в 1,2 раза у пациентов с ДЦП, способных глотать протертый стол и повышен у гастростомированных пациентов с дисфагией. VE GF-A имеет значимые корреляции с процентной долей безжировой массы и уровнем общей воды в организме по данным компонентного состава тела в группе стомированных пациентов с дисфагией, и значимые корреляции с процентной долей активной клеточной массы у пациентов глотающих самостоятельно. Превышения тропонина и ферритина у пациентов с ДЦП не выявлено.
Завьялова А. Н., Новикова В. П., Прудникова М. Д., Аль-Харес М. М., Гавщук М. В., Гурина О. П., Блинов А. Е., Варламова О. Н.
Материалы VI Национального конгресса с международным участием «Здоровые дети — будущее страны» FORCIPE том 5 Спецвыпуск 2 2022
Введение
Актуальность диагностики и реабилитации детей и подростков с болевым синдромом является важной задачей по преодолению и купированию боли. Известно, что у детей и подростков с болевым синдромом чаще всего выявляются симптомы боли в сочетании с депрессией, тревогой, астенией, бессонницей, гипервозбудимостью, нарушением эмоций и поведения.
Цель исследования. Проанализированы особенности диагностики и медицинской реабилитации детей и подростков с болевым синдромом
Материалы и методы. Были обследованы 2 группы детей и подростков (основная группа – 22 и контрольная – 18 человек). Для диагностики болевого синдрома были использованы методики САН (самочувствие, активность и настроение), нервно-психической адаптации (НПА), оценки уровня субъективного контроля (УСК), субъективной оценки состояния (СОС) и Спилбергера-Ханина (СП-Х). В основной группе реабилитационные мероприятия включали индивидуальную и групповую психотерапию, методики саморегуляции, мышечной релаксации и аутогенной тренировки. Групповые занятия проводили 2 раза в неделю (2 месяца) в течение 1,5 часов.
Результаты и их обсуждение. Полученные данные интегральной оценки по методике НПА после реабилитационных мероприятий в основной группе составило 3,6 стандартных баллов и свидетельствовало о достоверном снижении выявленных болезненных проявлений. По методике УСК было оценено отношение детей и подростков с болевым синдромом к проведенным реабилитационным мероприятиям. При этом была выявлена положительная динамика перехода экстернальности к интернальности с возрастанием от 4,3 до 5,9 стенов, что свидетельствовало о возрастании критичности и личной ответственности за благоприятный исход болевого синдрома. Показатель СОС после реабилитационных мероприятий в основной группе достоверно снизился с 21,3 до 12,5 баллов. Удалось добиться ремиссии длительностью свыше 3 месяцев у 14 человек, что составило 63,6% лиц основной группы. После осуществления мероприятий медицинской реабилитации показатели реактивной (χ2=56,5; С=0,87; р<0,05) и личностной тревоги (χ2=18,3; С=0,46; р<0,05) достоверно уменьшились и составили 41,7 и 40,9 условных показателей тревоги, соответственно.
Оценка показателей по методике САН свидетельствует, что осуществление медицинских реабилитационных мероприятий позволяет редуцировать симптомы боли, тревоги, астении, вегетативных нарушений, уменьшать раздражительность, нервозность, двигательную и психическую гипервозбудимость у большинства детей и подростков основной группы (63,6%). У детей и подростков основной группы была отмечена положительная динамика по клиническим показателям снижения страхов, чувства беспокойства, нервозности, взвинченности, суетливости, неусидчивости, тремора, непроизвольных движений руками, тревожным мыслям, снижению концентрации внимания, нарушению засыпания, головным болям, болям в спине и груди, обильного потоотделения и сердцебиения. По сравнению с показателями до реабилитации у детей и подростков основной группы было отмечено улучшение концентрации внимания, редуцировалась раздражительность, беспокойство и плаксивость.
При осуществлении реабилитационных мероприятий следует соблюдать ряд правил и принципов. В частности, реабилитация должна начинаться на ранних этапах лечения болевого синдрома. Комплексность реабилитации была достигнута участием в реабилитационном процессе мультидисциплинарной бригады в составе педиатров, врачей-альгологов, психотерапевтов, психиатров и психологов. Осуществлялось проведение непрерывного поэтапного и преемственного характера реабилитационных мероприятий в определенной последовательности в зависимости от специфики болевого синдрома. Партнерство достигалось с привлечением детей и подростков к активному участию в лечебно-реабилитационном процессе. Выполнялась индивидуальная программа реабилитации с подбором методов и средств восстановительной терапии в зависимости от пола, возраста, личностных особенностей ребенка и подростка, общего состояния и характера проводимого комплексного лечения и медицинской реабилитации. Реабилитационные мероприятия были направлены на возвращение детей и подростков к повторному участию в программах реабилитации для полного восстановления способности к обучению в школе.
Определено, что у детей и подростков основной группы с болевым синдромом реабилитационные мероприятия позволили купировать симптомы боли, укрепить веру в выздоровление, улучшить адаптацию, повысить мотивацию на преодоление боли. Очевидно, что целесообразно проводить аутогенную тренировку, саморегуляцию и мышечную релаксацию путем индивидуальной и групповой психотерапии.
Для профилактики рецидивов болевого синдрома рекомендуется проводить медицинские реабилитационные мероприятия по предупреждению обострений болевого синдрома; осуществлять комплекс мероприятий, направленных на повышение общей и иммунологической реактивности организма; поддержание способности к обучению на достигнутом уровне; улучшение общего состояния, способности по контролю своего поведения и предупреждение хронизации болевого синдрома.
Таким образом, медицинская реабилитация у детей и подростков с болевым синдромом представляет собой систему мероприятий, направленных на предупреждение неблагоприятных отдаленных последствий боли. В этапы медицинской реабилитации детей и подростков с болевым синдромом целесообразно включать своевременную диагностику коморбидных психических нарушений, их профилактику и психокоррекцию.
Источник: ДИАГНОСТИКА И РЕАБИЛИТАЦИИ ДЕТЕЙ И ПОДРОСТКОВ С БОЛЕВЫМ СИНДРОМОМ
Давыдов А.Т.1, Бутко Д.Ю., Даниленко Л.А., Артамонова М.В.
Сборник тезисов и материалов XXIV конгресса с международным участием давиденковские чтения. Под редакцией проф. Клочевой Е.Г., проф. Голдобина В.В. СПб.: 2022. – 396 с.
Введение
Аффективно-респираторные пароксизмы у детей (АРП) являются довольно частой причиной обращения родителей к детскому неврологу. Актуальность исследования АРП определяется высокой частотой встречаемости данной патологии, по разным данным от 0,1% до 8% детей в популяции. У изначально здоровых детей первых лет жизни внезапно случаются кратковременные (длительностью не более 1-2 минут) пароксизмы с апноэ, часто сопровождающиеся потерей сознания, нарушением постурального тонуса и вегетативными реакциями, реже – генерализованным тоническим напряжением конечностей. АРП могут наблюдаться как у здоровых, так и у детей с резидуально-органическим поражением ЦНС и/или эпилепсией, а также у детей с кардиальной патологией, что может создавать затруднения для дифференциальной диагностики этого заболевания.
Цель исследования
Изучить электроэнцефалографические особенности (рутинная ЭЭГ и относительные спектры мощности основных диапазонов ЭЭГ) на фоне открытых глаз у детей с аффективно-респираторными пароксизмами по сравнению с практически здоровыми сверстниками в возрасте 3-4 лет.
Материалы и методы
В исследовании приняли участие 33 ребенка в возрасте 3-4 лет с аффективно-респираторными пароксизмами и 16 детей, не имеющих в анамнезе неврологической и психиатрической патологии, травм головного мозга.
Регистрация электроэнцефалограммы (ЭЭГ) производилась с помощью 24-х канального цифрового электроэнцефалографа с 19 мостиковых хлорсеребряных электродов, расположенных на поверхности головы в соответствии с международной системой 10-20.
Клиническая электроэнцефалограмма включала в себя регистрацию ЭЭГ при закрытых и при открытых глазах в течение не менее 3-х минут. Рутинный анализ кривой состоял в оценке общего функционального состояния мозга, оценке тяжести изменений ЭЭГ и локализации патологических изменений. Относительная мощность ЭЭГ рассчитывалась и сравнивалась для записей «Глаза закрыты» и «Глаза открыты» в тета- (4-7 Гц), альфа1- (7-12 Гц), бета1-(14-20 Гц), бета2-диапазонах (20-30 Гц).
Обработка, усреднение и статистический анализ проводился с помощью в программы WinEEG. Различия считались достоверными при p<0,05.
Результаты и обсуждение
Знаков эпилептиформной активности у обследуемых детей зарегистрировано не было. В группе детей с АРП по сравнению со сверстниками из контрольной группы отмечалось увеличение диффузной медленноволновой активности, за счет увеличения волн тета-диапазона, у некоторых пациентов с АРП регистрировались единичные дельта- волны.
У 32,5% детей с АРП и у 22,5% детей контрольной группы отмечались билатерально синхронные вспышки тета-, дельта- волн в центрально-теменных, теменно-затылочных или лобно-центральных отведениях коры больших полушарий мозга, эпизодически эти вспышки могли принимать генерализованный характер.
При сравнении относительных спектров мощности ЭЭГ у детей с АРП были получены следующие результаты: на фоне открытых глаз отмечалось статистически значимое (p<0,05) увеличение относительной мощности волн тета-диапазона в затылочно-теменных отведения обоих полушарий (O1, O2, Р3, Рz, Р4), тогда как в других отведениях достоверных различий получено не было. Также статистически достоверных различий (p>0,05) между группой с АРП и группой контроля не наблюдалось в альфа-, бета- и дельта- диапазонах во всех анализируемых отведениях на фоне открытых глаз.
Вышеописанные изменения ЭЭГ свидетельствуют о наличии большей степени несформированности корково-подкорковых взаимоотношений у детей с АРП по сравнению с контрольной группой.
Польская А.В., Яковенко Е.А., Чутко Л.С.
Сборник тезисов и материалов XXIV конгресса с международным участием давиденковские чтения. Под редакцией проф. Клочевой Е.Г., проф. Голдобина В.В. СПб.: 2022. – 396 с.
Введение
Тревожные расстройства встречаются у 7-15% детей популяции. Наиболее частым проявлением тревожных расстройств у детей дошкольного возраста являются страхи. В отличие от страха, который соотносится с определенным стимулом и объектом, тревога обычно беспредметна, иррациональна и не имеет конкретного стимула.
Согласно наблюдениям А.И. Захарова, наибольшая чувствительность к страхам, как у мальчиков, так и у девочек проявляется в 6 лет. К этому возрасту в основных чертах завершается созревание эмоциональной сферы, развивается воображение и умение ставить себя на место другого человека, что расширяет восприятие страхов и делает их переживание более глубоким. Для страхов детей дошкольного возраста характерны: монотематичность, простое конкретное содержание, приступообразный характер, сочетание с яркими, визуальными, пугающими образами.
Цель исследования. Изучить нейрофизиологические особенности (относительные спектры мощности основных диапазонов ЭЭГ на фоне закрытых глаз, уровень внимания и импульсивности) у детей дошкольного возраста с тревожными расстройствами по сравнению с практически здоровыми сверстниками.
Материалы и методы.
В исследовании приняли участие 64 ребенка в возрасте от 5 до 7 лет (31 девочка и 33 мальчика), страдающих тревожными расстройствами (по МКБ- 10 F93.1). Группа практически здоровых сверстников – 30 детей.
Регистрация электроэнцефалограммы (ЭЭГ) производилась с помощью 24-х ка- нального цифрового электроэнцефалографа с 19 мостиковых хлорсеребряных электродов, расположенных на поверхности головы в соответствии с международнойсистемой 10-20. Клиническая электроэнцефалограмма включала в себя регистрацию ЭЭГ при закрытых и при открытых глазах в течение 3-х минут и проведение стандартных функциональных проб. Рутинный анализ кривой состоял в оценке общего функционального состояния мозга, оценке тяжести изменений ЭЭГ и локализации патологических изменений. Относительная мощность ЭЭГ рассчитывалась и сравнивалась для записей «Глаза закрыты» в тета- (4-7 Гц), альфа1- (7-12 Гц), бета1-(14-20 Гц), бета2-диапазонах (20-30 Гц).
Для оценки уровня внимания и импульсивности использовался тест непрерывной деятельности TOVA (the Test of Variables of Attention). Тест основан на предъявлении испытуемому в случайном порядке значимых (требующих ответной реакции) и незначимых (не требующих ответной реакции) стимулов, появляющихся на экране компьютера в виде геометрических фигур. Данные TOVA включают оценку уровня невнимательности (ошибки пропусков значимых стимулов), импульсивности (ошибки ложных нажатий на кнопку), скорости переработки информации (время реакции).
Результаты и обсуждение.
Психофизиологическое исследование TOVA показало, что у детей с тревожными расстройствами выявляется статистически достоверное повышение показателей импульсивности, как в первой (p<0,05), так и во второй половине теста (p<0,05). Достоверных отличий по показателям невнимательности (p>0,05) и времени реакции (p>0,05) в обеих половинах теста не отмечается. Таким образом, результаты психофизиологического теста показали высокий уровень импульсивности у детей с тревожными расстройствами, что свидетельствует о снижении тормозного контроля. Тормозной контроль отражает способность отказа от привычного, но признанного неверным в данной ситуации, действия, или способность игнорировать нерелевантную информацию.
При рутинном анализе ЭЭГ на фоне закрытых глаз у большинства детей наблюдались следующие изменения: повышение амплитуды фоновой ЭЭГ, преимущественно в затылочно-теменных отведениях обоих полушарий, заостренность фоновой ритмики, в затылочных или затылочно-теменных отведениях обоих полушарий, часто регистрируются группы полиморфных заостренных волн, высокоамплитудные полифазные потенциалы, отмечается тенденция распространения альфа-активности или альфа-подобной тета-активности в лобно-центральные отведения обоих полушарий. При проведении статистического анализа данных относительной мощности ЭЭГ на фоне закрытых глаз между исследуемой группой детей и контрольной группой показал, что увеличение мощности волн альфа-диапазона в затылочно-теменных (O2,O1, Р3, Р4, Pz) и лобно-центральных (F3, Fz, F4, С3, Cz, С4) отведениях обоих полушарий было статистически достоверно (p<0,05). В теменно-центральных отведениях отмечалось увеличение мощности волн тета-диапазона, но данное увеличение было статистически не достоверно (p>0,05).
Проведенный анализ спектров мощности ЭЭГ свидетельствует об увеличении мощности альфа-диапазона в лобно-центральных отделах коры больших полушарий мозга, что указывает на снижение активирующих влияний и увеличение синхронизирующих влияний таламических структур, следствием чего является недостаточный уровень активации неокортикальных структур. Данные изменения могут объяснить снижение тормозного контроля и снижение способности игнорирования нецелевых стимулов в тесте TOVA.
Источник: НЕЙРОФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ДЕТЕЙ ДОШКОЛЬНОГО ВОЗРАСТА С ТРЕВОЖНЫМИ РАССТРОЙСТВАМИ
Яковенко Е.А., Чутко Л.С., Сурушкина С.Ю., Анисимова Т.И.
Сборник тезисов и материалов XXIV конгресса с международным участием давиденковские чтения. Под редакцией проф. Клочевой Е.Г., проф. Голдобина В.В. СПб.: 2022. – 396 с.
Введение
Согласно данным современных исследований, от 70 % до 80 % недоношенных детей страдают патологией центральной нервной системы различного генеза, в ранней верификации и динамическом наблюдении которой особое диагностическое значение имеет ультразвуковое сканирование головного мозга. Изучение нейросонографической картины позволяет определить топику, характер поражения центральной нервной системы и особенности течения заболевания, что может быть использовано для разработки персонифицированного подхода в комплексной терапии данной нозологии.
Цель исследования
Выявление особенностей неврологического статуса с оценкой нейросонографических данных у недоношенных детей различного гестационного возраста для определения тактики патогенетической терапии и прогноза неврологических исходов.
Материалы и методы
Проведено рандомизированное проспективное исследование 75 недоношенных детей с гестационным возрастом от 26 до 36 недель, массой тела от 700 гр. До 2990 гр. на протяжении первых трех месяцев жизни. Дети были подразделены на 4 группы согласно гестационному возрасту: 1 группа — 14 детей с гестационным возрастом менее 28 недель, 2 группа — 18 детей с гестационным возрастом 28–31 неделя, 3 группа — 22 ребенка с гестацинным возрастом 32–34 недели, 4 группа — 21 ребенок с гестационным возрастом 35 — 36 недель. В динамике осуществлялась оценка неврологического статуса, проводилось нейросонографическое исследование с использованием аппарата Voluson 730 GeneralElectric и датчиков с частотой 3,5–5,5 М Гц. Критерии диагнозов перинатальных поражений ЦНС в неонатальном периоде соответствовали классификации, утвержденной Российской Ассоциацией Специалистов Перинатальной Медицины. Анализировался также характер проводимой респираторной терапии.
Статистическая обработка данных проводилась с помощью программы Statistica 10. Статистически достоверными считались различия между сравниваемыми показателями при p < 0,05.
Результаты
Выявлена обратная корреляционная зависимость между гестационным возрастом и потребностью в респираторной поддержке, тяжестью церебральной ишемии (ЦИ), степенью внутрижелудочковых кровоизлияний (ВЖК) и частотой развития перивентрикулярной лейкомаляции (ПВЛ) (r = -0,64, r = -0,51, r = -0,56, r = -0,71 соответственно, р < 0,05). Дети с гестационным возрастом менее 28 недель (1 группа) характеризовались преобладанием ЦИ III степени — 64,3 %, в 85,7 % случаев сочетающейся с ВЖК: ВЖК I степени (21,4 %), II степени (50 %), III степени (14,3 %). Перивентрикулярная лейкомаляция имела место у 21,4 % детей.
У детей с гестационным возрастом 28–31 неделя (2 группа) выявлена более высокая частота ЦИ II степени (88,9 %) с преобладанием ВЖК II степени (44,4 %). Частота ПВЛ в данной группе составила 16,6 %. Для обеих групп было характерно преобладание диффузных изменений на нейросонограмме с выраженными признаками незрелости и сглаженностью рисунка борозд головного мозга.
Пациенты в 3 и 4 группах характеризовались наименьшей частотой ПВЛ, а также сходными показателями распределения частоты ЦИ и ВЖК. Так в 3 группе отмечено снижение общего количества случаев ВЖК с преобладанием ВЖК I степени — 31,8 %, ВЖК II степени имело место в 13,6 % случаев, ВЖК III степени — в 4,5 % случаев, в 4 группе количество детей с ВЖК I и II степени составило 23,8 %, 4,8 % соответственно, на фоне преобладающей в обеих группах ЦИ II степени.
Согласно результатам динамического наблюдения, у 96 % из всех обследованных детей к концу первого месяца жизни развилась вентрикуломегалия, время возникновения и выраженность которой зависела главным образом от гестационного возраста, степени ВЖК, длительности респираторной поддержки и ее параметров, а также характера сопутствующего инфекционного процесса. К концу третьего месяца жизни у 47,9 % детей с вентрикуломегалией был отмечен регресс дилятационных процессов в желудочковой системе. В случае наличия ПВЛ уже ко второму месяцу жизни имела место кистозная трансформация пораженных участков головного мозга.
Заключение
Таким образом, недоношенные новорожденные в наибольшей степени подвержены поражению центральной нервной системы, основными патогенетическими механизмами которого могут являться циркуляторная, гемическая гипоксия, метаболические нарушения, несовершенная ауторегуляция церебрального кровотока, патология системы гемостаза и особенности проводимой терапии. Максимальная степень поражения центральной нервной системы характерна для детей с гестационным возрастом менее 28 недель с преобладанием, согласно нейросонографическим данным, диффузных изменений вещества головного мозга, ВЖК с развитием вентрикуломегалии и высоким риском ПВЛ с кистозной трансформацией.
Мультифакториальность поражения центральной нервной системы у данной категории пациентов определят необходимость разработки комплексного подхода в лечении с терапией не только церебральных дисфункций, но и коморбидной патологии, а также коррекции респираторной стратегии.
Брыксина Е. Ю., Летифов Г. М., Давыдова Н. А., Панова И.В., Домбаян С.Х.
FORCIPE том 5 Спецвыпуск 2 2022, Материалы VI Национального конгресса с международным участием «Здоровые дети — будущее страны»
Коррекция поливитаминной недостаточности должна быть направлена не только на дополнительный прием недостающих веществ, но и на улучшение их всасывания, а также синтез витаминов в организме. Основная масса витаминно-минеральных комплексов (ВМК) содержит рекомендованные дозы наиболее необходимых витаминов и микроэлементов. Но не все компоненты ВМК могут всасываться в полной мере, т. к. довольно часто у пациентов с поливитаминной недостаточностью имеются и проблемы с микробиотой кишечника, что снижает доступность содержащихся в ВМК ингредиентов. Данная статья посвящена вопросам целесообразности дополнительного приема витаминов, их роли в организме и проявлениям дефицита.
ВВEДEНИE
Витамины относятся к незаменимым пищевым веществам. Они необходимы для нормального обмена веществ, роста и развития организма, защиты от вредных факторов внешней среды, надежного обеспечения всех жизненных функций. Организм человека не синтезирует витамины и должен получать их в готовом виде в тех количествах, которые соответствуют физиологической потребности организма. Не являясь строительной и энергетической основой, витамины служат катализатором биохимических реакций. Они выступают как коферменты различных энзимов, участвующих в регуляции углеводного, белкового, жирового и минерального обмена. Даже в очень малых дозах витамины проявляют высокую биологическую активность, поддерживают рост и регенерацию тканей, принимают участие в репродуктивной функции, обеспечивают иммунную реактивность организма, поддерживают нормальную работоспособность всех органов и тканей. Отсутствие или недостаток витаминов обусловливает нарушение этих процессов и приводит к развитию различных патологий.
МAТEРИAЛЫ И МEТOДЫ
В разные годы проводились исследования обеспеченности витаминами детского населения в различных регионах Узбекистана, и все они свидетельствуют о широком распространении гиповитаминозных состояний, обусловленных недостаточным потреблением одновременно нескольких витаминов. Так, при обследовании школьников г. Ташкента недостаток витамина С (по его уровню в крови) был обнаружен у 38%, В2 — у 79%, В6 — у 64%, Е — у 22%, бета-каротина — у 84%, достигая по некоторым показателям дефицита. Аналогичные данные получены при обследовании детей дошкольного и школьного возраста из Андижага, Ферганы, Намангана, а также Джиззака и других регионов.
Изолированные и клинически манифестные гиповитаминозы, такие как цинга, болезнь бери-бери, пеллагра и др., в настоящее время встречаются редко. Однако дефицит витаминов и/или минеральных элементов может приводить к развитию других специфических болезней как проявлений гиповитаминозов или дисэлементозов. Большинство этих патологических состояний описаны в доступной медицинской литературе. В настоящее время гораздо более известны и распространены такие гиповитаминозы, как макроцитарная (пернициозная) гиперхромная анемия (дефицит витамина В), геморрагическая болезнь новорожденных (дефицит витамина К), рахит (дефицит витамина D).
РEЗУЛЬТAТЫ И OБCУЖДEНИE
В последние годы появляются данные о том, что полии олигогиповитаминозы могут вызывать снижение умственных способностей, задержку нервно-психического и интеллектуального развития детей. Считается, что наибольшее влияние на процессы запоминания, усвоения, переработки информации, память и внимание оказывает достаточный уровень витаминов группы В (пиридоксина и цианокобаламина). Опубликованы исследования, в которых выявлено влияние регулярного приема витаминов на когнитивные функции, а, в частности, тиамина — и на когнитивные функции, и на настроение. Детские неврологи и неонатологи встречаются с так называемыми «пиридоксин-зависимыми судорогами» (пароксизмы, вызванные недостатком витамина В6). В проведенных в течение последних лет исследованиях установлена связь между дефицитом витамина D и снижением способности к обучению, запоминанию и алекситимией (затруднением в описании собственных эмоций и эмоций других людей).
Уже неоднократно упоминалось, что усвоение витаминов и микроэлементов напрямую зависит от состояния ЖКТ, который играет немаловажную роль в синтезе некоторых витаминов, и заболевания ЖКТ вносят свой вклад в развитие гиповитаминозов.
Многочисленные исследования связывают развитие различных заболеваний с изменениями микробиоты кишечника. Бифидобактерии доминируют в огромном бактериальном сообществе кишечника здоровых детей, тогда как в зрелом возрасте уровень их содержания ниже, но относительно стабилен. При рождении уровень бифидобактерий самый высокий. Изменения в кишечной микробной колонизации в раннем детском возрасте могут привести к иммунной дисрегуляции, а в дальнейшем к высокой восприимчивости к заболеваниям.
Кишечная микробиота — это динамичная система, которая ежедневно перестраивается в соответствии с пищевым рационом. Микробиота как детей, так и взрослых имеет важное значение для пищеварения, она должна быть способна снабжать организм метаболическими предшественниками, биологически активными веществами, которые не присутствуют в рационе и не производятся самим организмом. Здоровая микробиота кишечника может модулировать метаболизм человеческого организма. Следовательно, при измененном составе микробиоты могут возникать различные нарушения обмена веществ.
ЗAКЛЮЧEНИE
Таким образом, основная тактика в педиатрии направлена на профилактику, поскольку своевременно начатая витаминотерапия помогает предотвратить развитие витаминодефицитных состояний и их последствия. Нужно помнить, что прием ВМК необходим не только детям с уже имеющимися нарушениями здоровья, но и здоровым детям в течение всего года, независимо от сезонного употребления фруктов и ягод. Оптимальным вариантом будет прием ВМК совместно с пребиотиками, пробиотиками и бифидобактериями, что улучшит состояние микробиоты кишечника, обеспечит профилактику и лечение различных заболеваний (ожирения, сахарного диабета, аллергии и др.).
Источник: ЗНАЧЕНИЕ ПЕДИАТРИИ В КОРМЛЕНИИ ДЕТЕЙ ВИТАМИНАМИ И МИНЕРАЛЬНЫМИ ВЕЩЕСТВАМИ
Абдуллаева Н.Ж.
Экономика и социум. 2023. №3-1 (106).
Цель исследования. Представить многообразие клинических проявлений патологии нервной системы и трудности диагностического поиска при наследственных нарушениях N-гликозилирования I типа (CDG-синдромах I типа).
Материалы и методы.
В исследование включены 5 пациентов: 1 с PMM2-CDG (CDG-Ia, болезнь Жакена) и 4 с ALG1-CDG (CDG-1k) из 2 неродственных семей. Фенотип пробандов оценивался с использованием данных клинических осмотров, лабораторных и инструментальных обследований, консультаций врачей-специалистов, результатов аутопсии и гистологических исследований образцов органов умерших лиц. Для проведения изоэлектрического фокусирования трансферрина (ИЭФТ) и определения активности арилсульфатазы А (АрА) использовали образцы сыворотки крови пробандов и здоровых сибсов. Молекулярно-генетические исследования образцов ДНК пациентов и их родителей проведены методами высокопроизводительного секвенирования (NGS) и секвенирования по Сэнгеру (СС).
Результаты и обсуждение.
У пробанда 1 с рождения отмечали срыгивания, мышечную гипотонию, гипорефлексию. В возрасте 2 мес. отмечены отставание в психо-моторном развитии, мышечная гипотония, сходящееся косоглазие, бульбарные нарушения, черепно-лицевые дисморфии, инвертированные соски, линейные участки атрофии подкожно-жирового слоя на голенях, локальное отложение жировой ткани в области щек, врожденный порок сердца, увеличение печени, диффузные изменения в паренхиме почек. В возрасте 3 мес. выявили гипоплазию мозжечка. При лабораторном обследовании: повышение активности АрА, трансаминаз, концентрации тиреотропного гормона в сыворотке крови. При ИЭФТ – аномальный профиль гликозилирования. При СС гена PMM2 у пациентки были выявлены патогенные мутации p.Gly57Arg и p.Agr141His и установлен диагноз PMM2-CDG.
Родители пробандов 2, 3 и 4 обратились за медико-генетическим консультированием в связи с рождением дочери, умершей на 45 сут. после рождения. Состояние ребенка с момента рождения было крайне тяжелым: отмечались судорожный синдром, гипоальбуминемия, отечный синдром, нарастающие явления полиорганной недостаточности. По результатам аутопсии: дисплазия шейного отдела спинного мозга (СМ), отек головного мозга (ГМ), мелкоочаговые постгипоксические кровоизлияния в оболочки ГМ и СМ, в сосудистые сплетения, субэпендимальные отделы вещества ГМ, отек мягких тканей головы, лица, нижних конечностей, бронхопневмония, геморрагический синдром с мелкоочаговыми кровоизлияниями в легкие, почки и надпочечники, асцит, гепатоспленомегалия, серозный гепатит. Далее в семье родились еще 2 детей, у которых с рождения наблюдались мышечная гипотония, гипорефлексия, судорожный синдром, отеки вследствие гипоальбуминемии, геморрагический синдром, черепно-лицевые дисморфии. У пациентов зафиксировано повышение активности АрА, трансаминаз, снижение концентрации тироксина, холестерина, альфа-1-антитрипсина. Оба ребенка умерли на 1-м году жизни. При аутопсии: отек мягкой мозговой оболочки, значительное снижение массы мозжечка, уменьшение числа мотонейронов в зубчатом ядре мозжечка, оливах продолговатого мозга, выпадение мотонейронов в передних рогах шейного и грудного отделов СМ, интерстициальные кровоизлияния в легкие, гидроперикард, асцит. При NGS у родителей пациентов выявлены варианты в гене ALG1, описанные в литературе как патогенные: p.Ser258Leu – у матери, у отца – p.Phe394Leu. Компаундное гетерозиготное носительство этих мутаций было подтверждено СС у одного их умерших детей. При ИЭФТ образца сыворотки крови, полученного от этого ребенка, был выявлен аномальный профиль изоформ трансферрина. На основании результатов исследования случаи заболевания в семье классифицированы как ALG1-CDG.
У пробанда 5 заболеванием манифестировало в 3 мес. возникновением судорог. При обследовании выявлена асимметрия свода черепа, расширение ликворных пространств, асимметричная вентрикуломегалия, повышение активности трансаминаз. Cо временем отмечалась выраженная задержка психо-моторного развития, частота судорожных приступов нарастала, прогрессировали явления атрофии вещества ГМ. В 2 года диагностированы: прогрессирующее нейродегенеративное заболевание с корково-подкорковой атрофией мозга, выраженным нарушением психо-речевого, моторного развития, фармакорезистентной эпилепсией. ДЦП атонически-астатическая форма. Смешанная гидроцефалия с умеренной диффузной атрофией вещества ГМ. Субклинический гипотиреоз. Расходящееся косоглазие. Анемия легкой степени. Гепатопатия. При NGS (CeCat, Germany) выявлены ранее не описанные варианты в гене ALG1: p.Glu288Glyfs*23 и p.Thr261Ala. При исследовании сыворотки крови выявлено повышение активности АрА, аномальный профиль изоформ трансферрина и установлен диагноз ALG1-CDG. CDG-синдромы I типа имеют распознаваемый фенотип, который характеризуется доминированием в клинической картине разнообразной неврологической симптоматики и сочетанием поражения нервной системы с патологией внутренних органов, костно-мышечной, эндокринной, иммунной, кроветворной систем, органа зрения, характерными дисморфиями, изменениями кожи и подкожной клетчатки. Ввиду редкости и недостаточной осведомленности врачей о наследственных нарушениях N-гликозилирования I типа эта специфическая картина часто остается неузнанной. В описываемых случаях клинический фенотип CDG- синдрома I типа был распознан только у пробанда 1. У пациентов 2, 3 и 4 «ключом к диагнозу» стали разнонаправленные изменения сывороточных гликопротеинов: АрА, трансаминаз, тироксина, холестерина, альфа-1-антитрипсина, косвенно свидетельствующие о нарушениях процессов гликозилирования в организме. У пробанда 5 вероятность наследственного нарушения гликозилирования до получения результатов NGS не обсуждалась.
Целесообразно включать в обследование всех пациентов с признаками поражения нервной системы ИЭФТ или определение активности АрА в сыворотке крови в качестве скринирующего теста на CDG-синдромы I типа.
Гусина А.А., Гусина Н.Б., Румянцева Н.В., Калинина Е.А., Мотюк И.Н., Бойша А.С., Зиновик А.В., Мясников С.О., Кульпанович А.И.
Сборник тезисов и материалов XXIV конгресса с международным участием давиденковские чтения. Под редакцией проф. Клочевой Е.Г., проф. Голдобина В.В. СПб.: 2022. – 396 с.
В статье дается краткий обзор проблемы развития речи у детей дошкольного возраста с общим недоразвитием речи. Описана процедура проведения обследования дошкольников. Представлены результаты исследования фразовой речи дошкольников рассматриваемой группы. Выявлены специфические особенности сформированности фразовой речи у детей среднего дошкольного возраста. Дан качественный и количественный анализ результатов сформированности фразовой речи у группы дошкольников. Описаны этапы разработки коррекционной работы с дошкольниками. Рассматривается содержание логопедической работы по формированию фразовой речи детей с ОНР II уровня. Представлены сюжетно-ролевые игры, как эффективное средство для развития фразовой речи у дошкольников. Экспериментально доказана эффективность предложенного содержания логопедической работы с детьми среднего дошкольного возраста с ОНР II уровня.
Введение
Проблема формирования фразовой речи дошкольников с общим недоразвитием речи II уровня (далее – ОНР) обусловлена как на научно-методическом, так и на социально-педагогическом уровне. С учетом требований, представленных в Федеральном государственном образовательном стандарте дошкольного образования (далее Стандарт), определена важность и необходимость организации и совершенствования всестороннего развития дошкольников. Одним из таким важных направлений в Стандарте по всестороннему развитию детей дошкольного возраста, является речевое и социально-коммуникативное развитие, где в качестве целевых ориентиров, как основ преемственности дошкольного и начального общего образования, определяется способность дошкольников договариваться, уметь выражать мысли и потребности, вести диалог и т.д., что затруднительно осуществить без сформированной на достаточном уровне фразовой речи.
Проведенный анализ литературных источников выявил (В.П. Глухов, Т.Б. Филичева, Г.В. Чиркина, и др.), что, с одной стороны, достаточная сформированность фразовой речи играет важную роль в социально-коммуникативном развитии ребенка дошкольного возраста, а с другой, показала недостаточное развитие фразовой речи у дошкольников с ОНР II уровня, что не позволяет осуществлять качественную коммуникацию со взрослыми и сверстниками. Основное внимание исследователей, занимавшихся проблемой исследования фразовой речи дошкольников с речевым недоразвитием, направлено на изучение сформированности умения составлять предложения и его лексико-грамматическое оформление.
Но в то же время недостаточная научная разработанность проблемы формирования фразовой речи у дошкольников 4-5 лет с ОНР II уровня в процессе использования сюжетно-ролевой игры определила необходимость разработки и апробации содержания коррекционно-логопедической работы.
Изложение основного материала статьи
С целью изучения сформированности фразовой речи у детей среднего дошкольного возраста с ОНР II уровня проведено исследование состояния фразовой речи дошкольников 4-5 лет с ОНР II уровня. За основу были взяты задания и методические приемы выдающихся отечественных авторов в области отечественной логопедии В.П. Глухова, Р.И. Лалаевой, Е.В. Мазановой, Т.Б. Филичевой, Г.В. Чиркиной, а также использовался картинный материал Т.Н. Новиковой-Иванцовой, Е.В. Мазановой, И.А. Смирновой.
Авторский вклад заключался в описании процедуры обследования фразовой речи у дошкольников 4-5 лет с ОНР II уровня, структурировании заданий с учетом применения моделей предложения в связной диалогической и монологической речи, формулировании речевой инструкции к каждому заданию (доступной для понимания дошкольников с ОНР II уровня), а также описании параметров оценки.
Методика эксперимента включала в себя два раздела заданий: I раздел – исследование состояния сформированности импрессивной речи (выполнение инструкций, подбор сюжетной картинки к фразе, дифференциация видовременных и приставочных форм глаголов, понимание предложно-падежных конструкций); II раздел – исследование состояния сформированности фразовой речи, а именно: а) составление изолированных предложений (составление предложений по трем картинкам, составление предложения по сюжетной картинке, повторение предложений разной структуры); б) употребление предложений в связной речи (связная диалогическая речь: беседа; связная монологическая речь: составление рассказа по серии сюжетных картин). Диагностическая методика предполагала оценку сформированности умения применять доступные модели предложения в связной диалогической и монологической речи. При оценке состояния сформированности импрессивной речи детей среднего дошкольного возраста с ОНР II уровня обращалось внимание на самостоятельность, правильность и скорость выполнения предложенных заданий.
В ходе анализа полученных данных по первому разделу методики было выявлено, что большинство дошкольников с ОНР II уровня демонстрируют уровень сформированности импрессивной речи ниже среднего. Были выявлены следующие специфические особенности: трудности понимания детьми трехступенчатых инструкций; сложности переключения с одного действия на другое при восприятии инструкций; трудности понимания предложно-падежных конструкций в составе фразы; трудности дифференциации приставочных (выливает – переливает), видовременных (ест – поела) форм глаголов, близких по значению глаголов (рисует – красит), что искажало понимание и смысл фразы в целом.
Перейдем к результатам исследования фразовой речи у дошкольников с ОНР II уровня. При изучении способности составлять изолированные предложения большинство дошкольников показали уровень сформированности фразовой речи ниже среднего. Фразы дошкольников отличались бедностью лексического наполнения, смысловой незавершенностью, нарушением согласования слов в предложении, ошибочным употреблением предлогов в при конструировании предложений. При изучении способности дошкольников применять модели предложений в связной диалогический и монологической речи, дошкольники с ОНР II уровня показали низкие результаты. В процессе беседы дети использовали короткие грамматически ошибочные фразы или отвечали односложно. Составление рассказа по серии картинок оказалось недоступно для дошкольников с ОНР II уровня. При сопоставлении полученных данных по второму разделу методики отмечается наличии диссоциации между относительной сформированностью фразовой речи при построении изолированных предложений и выраженными сложностями в применении сформированных моделей предложений в связной диалогической и монологической речи.
Таким образом, специфика нарушений фразовой речи у дошкольников с ОНР II уровня касается как процесса внутреннего программирования структуры предложения, так и реализации внешней программы в виде грамматически правильного оформления и последовательности изложения.
С учетом выявленных особенностей сформированности фразовой речи дошкольников с ОНР II уровня возникла необходимость определения содержания коррекционно-логопедической работы с дошкольниками 4-5 лет. Для реализации поставленной цели были сформированы две группы дошкольников 4-5 лет с ОНР II уровня: экспериментальная и контрольная. Дошкольники, вошедшие в состав экспериментальной группы, приняли участие в обучающем эксперименте. С данной группой дошкольников проводилась работа по формированию фразовой речи средствами сюжетно-ролевых игр. С дошкольниками, вошедшими в состав контрольной группы, работа осуществлялась логопедом дошкольного образовательного учреждения традиционными методами (конструирование фразы по картинкам). В качестве основного средства формирования фразовой речи у рассматриваемой группы дошкольников с ОНР II уровня использовалась сюжетно-ролевая игра, которая по мнению ряда отечественных и зарубежных ученых рассматривается как важный потенциал в речевом и коммуникативном развитии ребенка дошкольного возраста (С.Н. Литвинова, А. Pellegrini и др.).
В данных исследованиях рассматриваются функции сюжетно-ролевой игры: деятельностная, социокультурная, коммуникативная, коррекционная и функция самореализации. Следовательно, возникла необходимость осуществления параллельного развития фразовой речи и сюжетно-ролевой игры у дошкольников экспериментальной группы.
Было определено содержание логопедической работы и выделено два этапа: обучающий и коммуникативный. На обучающем этапе осуществлялось обучение дошкольников с ОНР II уровня умению строить простые нераспространенные и малораспространенные фразы. Основными задачами обучающего этапа являлись: обогащение и расширение словаря; развитие понимания синтаксических конструкций различных типов; развитие грамматического строя речи; стимуляция потребности в игре; обучение сюжетно-ролевой игре и совершенствование предметно-содержательной стороны игры.
На коммуникативном этапе осуществлялось закрепление умения строить простые нераспространенные и малораспространенные фразы в условиях, максимально приближенных к реальному речевому общению. На данном этапе осуществлялась реализация следующих задач: закрепление умения строить фразу в связной диалогической речи; обогащение функционального содержания игры; усложнение построения семантико-синтаксического строения фраз.
Поставленные задачи в рамках каждого этапа реализовывались параллельно в ходе обучения дошкольников сюжетно-ролевой игре, а не в рамках отдельных видов деятельности. Было определено дифференцированное содержание коррекционно-логопедической работы и подобран речевой материал для дошкольников с благоприятным и неблагоприятным вариантом развития фразовой речи. Для дошкольников с неблагоприятным вариантом развития фразовой речи подбирался более простой речевой материал, а содержание сюжетно-ролевой игры было менее разнообразным, нежели с дошкольниками с благоприятным прогнозом развития фразовой речи.
Содержание коррекционной работы отразилось в программе логопедических занятий по развитию фразовой речи дошкольников 4-5 лет с ОНР II уровня, которые проводились в рамках коррекционного курса «Развитие речи».
После обучающего эксперимента был проведен контрольный срез с целью оценки эффективности предложенного содержания логопедической работы. Контрольный эксперимент проводился по тем же блокам диагностических заданий, что и на этапе исследования. Анализ данных исследования импрессивной речи дошкольников с ОНР показал, что дети экспериментальной группы показали более высокие, нежели дошкольники контрольной группы, результаты в овладении фразовой речью как при употреблении изолированных предложений, так и в применении сформированных моделей предложений в общении со взрослыми.
Выводы
Таким образом, полученные результаты свидетельствуют о важности использования сюжетно-ролевой игры, как эффективного средства формирования фразовой речи, позволяющей реализовать коммуникативный подход к речевому развитию детей среднего дошкольного возраста с общим недоразвитием речи II уровня.
Источник: ФОРМИРОВАНИЕ ФРАЗОВОЙ РЕЧИ ДОШКОЛЬНИКОВ С ОБЩИМ НЕДОРАЗВИТИЕМ РЕЧИ II УРОВНЯ
Агаева И. Б.
Проблемы современного педагогического образования. 2023. №78-1.
Актуальность
Недоношенность является фактором риска нарушений развития в детском возрасте и остается серьезной проблемой общественного здравоохранения. Низкий гестационный возраст неразрывно связан с неонатальной смертностью и с кратко-срочными, отдаленными неврологическими последствиями различной степени выраженности, включая инвалидизацию. В течение многих лет в центре внимания исследователей находится изучение развития очень недоношенных и крайне недоношенных детей (<32 недель гестации). При этом, исследований по изучению неврологического развития детей, родившихся на поздних сроках недоношенности мало и зачастую их результаты, носят противоречивый характер, что в ряде случаев обусловлено особенностями дизайна, критериями включения, исключения и другими методологическими отличиями.
Цель. Определить частоту неврологических и речевых нарушений у детей с недоношенностью в возрасте трех лет.
Материалы и методы. Выполнено ретроспективное исследование пациентов раннего возраста, обратившихся на консультацию к неврологу в период с 2021 по 2022 год. Критерием включения являлся установленный диагноз задержки речевого или психоречевого развития в возрасте 3 года, при этом наличие неврологической патологии со стороны двигательной системы не являлся исключающим фактором. При оценке анамнестических данных в случае установления недоношенности применялась классификация, согласно которой: крайне недоношенные – это дети с рождением в сроке менее 28 недель гестации, очень недоношенные – от 28 по 31 неделю (включительно), умеренно недоношенные – от 32 по 33 неделю (включительно) и поздние недоношенные – от 34 до 37 недели. Все пациенты осмотрены врачом-неврологом, дефектологом, психологом, оториноларингологом, в ходе исследования исключены нарушения слуха (аудиологическое исследование). Из исследования исключались пациенты с выявленными врожденными пороками развития центральной нервной системы (по результатам нейровизуализации), с эпилепсией с дебютом в доречевом периоде. С учетом критериев включения, исключения за отчетный период в исследовании приняло участие 180 детей (n=180). При недоношенности выполнено условие коррекции возраста по сроку гестации.
Результаты.
Анализ анамнестических данных показал, что в 84 случаях (46,7%) у детей имел место анамнез недоношенности. Оценка структуры недоношенности (n=84) выявила, что более чем в половине случаев (53/84; 63,1%) у детей отмечалась поздняя недоношенность. При сравнении групп детей с поздней недоношенностью (n=53) и детьми с недоношенностью до 34 недель (n=31), установлено, что патологическая симптоматика в неврологическом статусе (со стороны двигательной и координационной системы) значимо не различалась: 47,2% и 48,4%, соответственно (p>0,05). Среди жалоб, сопутствующих задержке речевого развития, лидировали: неловкость, дискоординация, трудности в коммуникации, адаптационные расстройства и нарушения сна.
Выводы
Почти каждый второй ребенок с поздней недоношенностью в возрасте 3 лет имеет неврологические нарушения, включая задержку речевого развития, что требует более пристального внимания к данной гестационной когорте, поскольку в большинстве случаев эта степень недоношенности не расценивается как фактор риска, а лечение, вмешательство начинаются поздно.
Жевнеронок И.В., Лемеш О.Ю.
Сборник тезисов и материалов XXIV конгресса с международным участием давиденковские чтения. Под редакцией проф. Клочевой Е.Г., проф. Голдобина В.В. СПб.: 2022. – 396 с.
Коморбидное заболевание нервной системы, включающее в себя детский церебральный паралич (ДЦП), отягощенный эпилепсией, являются одной из основных патологий центральной нервной системы у детей и причиной ранней инвалидизации. По мнению К. А. Семеновой, ДЦП представляет собой объединение групп различных по клиническим проявлениям синдромов, которые возникают в результате недоразвития мозга и его повреждений на различных этапах онтогенеза, ведущим к неспособности сохранения нормальной позы и выполнения произвольных движений. Таким образом, детский церебральный паралич (ДЦП) как последствие грубого нарушения работы центральной нервной системы ребенка в перинатальный период является исключительно сложным заболеванием детского возраста.
Эпилепсия как нозологическая единица представляет собой хроническое заболевание головного мозга, вызванное чрезмерными нейронными разрядами в коре головного мозга и характеризующееся циклическими, постоянно повторяющимися приступами, которые сопровождаются нарушениями сознания, двигательными, вегетативными, чувствительными и когнитивными нарушениями.
Клинические исследования последних лет показали, что эпилепсия является одной из наиболее распространенных и важных сопутствующих патологий среди пациентов с церебральным параличом (ДЦП). Такое коморбидное расстройство вызвано морфологическими и функциональными нарушениями, образующимися вследствие повреждения мозговых структур в перинатальный период. По данным, полученным в исследовании Холиным А. А. с соавт. было установлено, что у 25–75% больных с церебральными параличами наблюдается развитие эпилептических синдромов.
Распространенность эпилепсии в раннем возрасте составляет около 10 случаев на 1000 детей. Согласно результатам последних исследований, сочетание ДЦП и эпилепсии составляет приблизительно 0,69 на 1000 новорожденных. Появление эпилептических приступов и сопутствующей патологии усугубляет клиническую картину ДЦП, а также осложняет проведение терапевтических и реабилитационных мероприятий, влияет на прогноз двигательных и когнитивных функций .
Этиологические факторы, провоцирующие развитие детского церебрального паралича и эпилепсии во многом схожи. Наиболее часто встречающимися являются: гипоксически-ишемическое поражение головного мозга (69%), внутриутробные инфекции (9%), церебральные пороки развития (7%). Общая осведомленность и понимание закономерностей формирования этих заболеваний позволяет более точно определить потенциальную вероятность развития коморбидного расстройства, т.е. спрогнозировать возможное появление эпилепсии на фоне ДЦП.
Анализируя клинические данные, совершенно точно можно утверждать, что частота встречаемости эпилепсии при разных формах ДЦП различна, однако сохраняется в среднем в популяции. Так по данным исследования, проведенного Е. Д. Белоусовой, до 43,2% случаев развития ДЦП сопровождаются эпилепсией и эпилептиформными расстройствами. Такие же данные подтверждают международные исследования. Например, в результате популяционного исследования, проведенного в Швеции, было зафиксировано, что 44% детей с детским церебральным параличом имеют диагноз эпилепсия. Наибольшая вероятность развития эпилепсии отмечается при гемиплегической (70,6%) и тетраплегической (66,1%) формах ДЦП.
В случаях кортикальной дисплазии, пороков развития коры головного мозга, вызванных различными этиологическими факторами, наблюдается резкое увеличение вероятности развития эпилепсии у детей – в 3,5 раза. Отмечено, что степень двигательных нарушений и общего психического недоразвития также прямо коррелирует с повышенной вероятностью развития эпилепсии при ДЦП.
Согласно клиническим наблюдениям эпилептические приступы, сопровождающие ДЦП в раннем возрасте приводят к более тяжелому клиническому течению заболевания, выраженным трудностям в терапии и реабилитации, а также значительному снижению качества жизни пациентов. Несмотря на диффузное распространение перинатального поражения головного мозга, эпилептические приступы у пациентов в основном имеют фокальный характер. Это и определило направление и содержание нашего исследования. Гипотезой исследование стало предположение о том, что при влиянии разных этиологических факторов возможно формирование коморбидного расстройства, сочетающего в себе детский церебральный паралич и эпилепсию.
Цель исследования – изучить особенности взаимосвязи между такими патологиями, как эпилепсия и ДЦП у детей вследствие перинатального поражения ЦНС.
Результаты. Аналитическое изучение анамнеза детей с диагнозом ДЦП позволило изучить влияние разных этиологических факторов в перинатальном возрасте на формирование этого заболевания нервной системы. Статистический анализ данных позволил определить существенную связь между хронической гипоксией плода и развитием ДЦП. Согласно половой принадлежности среди исследуемых детей преобладали мальчики в соотношении 1,2:1.
Также значительную роль в этиологии ДЦП играют инфекционные агенты. Инфекционная этиология выявлена у 9% (7/80) пациентов, смешанный генез поражения – в 24% (19/80) случаев. Однако самым распространенным этиологическим фактором является поражения ЦНС в результате гипоксии. На долю гипоксически-ишемических поражений головного мозга в нашем исследовании пришлось 50% (40/80) клинических случаев, гипоксически-геморрагических поражений – 17% (14/80). Необходимо отметить, что тяжелые гипоксические состояния приводят к перивентрикулярной или субкортикальной лейкомаляции. При этом возникшие структурные изменения в результате поражения головного мозга не всегда могут проявляться клинической патологией сразу после рождения. Недоразвитие и незрелость периферических сегментарных отделов нервной системы могут скрывать пирамидные и экстрапирамидные нарушения. Выраженная спастичность мышц и пирамидные синдромы могут проявиться только к 6–7 месяцу жизни ребенка, а экстрапирамидные синдромы могут быть диагностированы только 2–3 годам.
При анализе полученных данных было обнаружено, что большая часть детей (49%) при рождении не имели энцефалопатий на фоне гипоксии, т.е. оценка по шкале Апгар была 8–10 баллов, в то же время 41% родились со средней и тяжелой степенью асфиксии.
Оценку по шкале Апгар при рождении в 8–10 баллов (нет асфиксии) имели 49% (39/80) обсле-
дуемых детей, 6–7 баллов (легкая асфиксия) – 10% (8/80), 4–5 балла (умеренная асфиксия) – 16% (16/80), 1–3 балла (тяжелая асфиксия) – 25% (20/80). Наследственность по эпилепсии была отягощена у 4% (3/80) больных.
Клиническими проявлениями лейкомаляции в первые 4 месяца были вялые парезы в ногах, однако к 5–6 месяцу вялые парезы сменились спастическими. Среди форм ДЦП в исследуемых случаях чащ встречались гемипаретическая – 23% (18/80 и спастический тетрапарез – 39% (31/80).Также выявлены спастическая диплегическая – в 11% (8/80) случаев, двойная гемиплегическая – в 15% (13/80). Наблюдались также смешанные формы в виде спастикогиперкинетической – у 6% (4/80), спастикоатактической – у 3% (3/80) и атонико-астатической– у 3% (3/80) детей.
Была проанализирована степень тяжести ДЦ в исследуемых случаях по GMFCS. При этом количество проанализированных случаев составило 74 а не 80, так как классификация GMFCS используется у детей только с 2 лет, а диагноз ДЦП может быть поставлен ребёнку с года.
Были получены следующие статистические данные: I. уровень (ходьба без ограничений) установлен 5% (4/74); II. уровень (ходьба с ограничениями) – у 16% (12/74); III. уровень (ходьба с использованием ручных приспособлений для передвижения) – у 14% (10/74); IV. уровень (самостоятельное передвижение ограничено, могут использоваться моторизированные средства передвижения) выявлено 20% (15/74); V. уровень (полная зависимость ребёнка от окружающих) – в 45% (33/74) случаев.
Начало эпилептических приступов отмечалось с первого дня жизни до 14 лет (табл. 3). Наибольшая концентрация дебюта припадков (26%: 21/80) у детей с ППЦНС наблюдалась возрасте от одного до 6 месяцев. Почти у четверти детей припадки манифестировали в возрасте с 3 до 5 лет – 20% (16/80). Установлено, что для ДЦП характерны фокальные формы эпилепсии (68%), а также комбинированная эпилепсия с фокальными и генерализованными припадками (в том числе с эпилептическими спазмами) (24%).
Клинико-ЭЭГ- формы эпилепсии распределились следующим образом. Фокальные формы в дебюте заболевания представлены в основном симптоматической фокальной эпилепсией без четкого очага в 61% (49/80), а также наблюдались единичные случаи фокальной лобной и височной эпилепсии,
ФЭКСИМ-ДЭПД и фебрильных судорог. В динамике доля симптоматической фокальной эпилепсии без четкого очага выросла до 70% (56/80), симптоматической фокальной лобной – до 3% (2/80), ФЭКСИМ ДЭПД – до 6.3% (5/80).
Среди комбинированнных форм (с фокальными и генерализованными припадками) в дебюте болезни диагностированы: синдром Отахара – у 6% (5/80), синдром Веста – у 24% (19/80). В динамике
среди комбинированных форм эпилепсии у детей превалировал.
Фармакорезистентное течение имели 7% (5/72) пациентов. Пациенты с ПП ЦНС и фармакорезистентными формами ДЦП распределились следующим образом: 11% (8/80) – спастическая диплегическая), 15% (13/80) – двойная гемиплегическая и 39% (31/80) – спастический тетрапарез.
Выводы
Заболеваемость изученной коморбидной патологией (ДЦП + эпилепсия) преобладает у мальчиков. При рождении дети с перинатальным поражением ЦНС практически в равной степени могут иметь проявления асфиксии различной степени (51%) или быть практически здоровыми (49%, высший балл по шкале Апгар), с последующим развитием клинических проявлений в перинатальном периоде и позже и формированием ДЦП и манифестацией эпилепсии.
Отягощенная наследственность по эпилепсии как фактор риска ее развития имеет место у пациентов с перинатальным поражением ЦНС. Возраст начала эпилептических припадков у детей с ДЦП вследствие ПП ЦНС наблюдался чаще в первые пол года. У детей с ДЦП и перинатальным поражением ЦНС преобладают фокальные формы эпилепсии. У детей с ПП ЦНС отмечается большое разнообразие как форм ДЦП, так и клинико-ЭЭГ-синдромокомплексов симптоматической эпилепсии.
Фармакорезистентное течение эпилепсии преимущественно имели дети с двойной гемиплегической формой ДЦП.
Источник: ДЕТСКИЙ ЦЕРЕБРАЛЬНЫЙ ПАРАЛИЧ И ЭПИЛЕПСИЯ: ДВЕ НОЗОЛОГИИ, ОДНА ЭТИОЛОГИЯ
Шанавазова М. Д., Аскевова М. А., Абдулсемедова Д. А., Койчакаева А. С., Абулаева Д. Р. Медицина. Социология. Философия. Прикладные исследования. 2023. №2.
Введение
Острые респираторные инфекции у детей представляют особый интерес, из-за высокой заболеваемости и возможных осложнений в нервной системе. COVID-19 как среди взрослого населения, так и у детей характеризуется быстрым распространением, тяжестью клинических проявлений, а также наличием выраженных когнитивных нарушений, нарастание дефицита которых приводит к социально-трудовой дезадаптации, увеличению поведенческих нарушений и трудностей в обучении.
Цель исследования. Изучение структуры расстройств высших мозговых функций (ВМФ) у детей, перенесших COVID-19.
Материал и методы исследования
Для определения уровня когнитивных нарушений нами было обследовано 86 детей, перенесших COVID-19 в возрасте от 5 до 15 лет при помощи нейропсихологического теста Векслера для детей.
Результаты и обсуждение
Во время клинико-психологического обследования детей с постковидным синдромом, выявлен ряд расстройств эмоционально-поведенческой сферы – быстрая умственная и даже физическая утомляемость, нервозность, отказ от контакта с врачом, снижение концентрирования внимания и бедность других психо-моторных реакций. Снижение поазателей были выявлены преимущественно в следующих вербальных тестах: «Кубики Кооса», «Арифметический» и «Повторение цифр».
Сравнительный анализ показателей III субтеста («Арифметический») показал, что правильные ответы были получены только у 48% при выполнении первых 5 заданий, у 30% при выполнении 6-10 заданий, у 22% – 11-14 заданий. Попытки повторных исследований после длительного перерыва также не увенчались успехом, что свидетельствует о повышенной истощаемости внимания детей с постковидным синдромом, и причем у детей с постковидной энцефалопатией показатели данного субтеста были намного ниже. При выполнении субтеста «Повторение цифр» у детей с постковидной энцефалопатией статистически достоверно было ниже, чем у детей с постковидной астенизацией неврной системы. Обследуемые дети работу с кубиками Кооса выполняли с ошибками, что говорит о частичном срыве формирования программы и выбора средств решения задачи, т.е., по выражению А. Р. Лурия, о нарушении стадии выработки общей стратегии мышления. При усложнении условий выполнения задач с кубиками Кооса количество правильно выполненных заданий резко уменьшилось.
Выводы
Таким образом, проведенный нейропсихологический анализ высших корковых функций у детей с постковидным синдромом показал, что когнитивная деятельность имеет тенденцию к снижению после перенесенного COVID-19. Изучение когнитивных нарушений с помощью нейропсихологических тестов позволяет выявить не только общемозговые нарушения, но и дисфункцию ассоциативных мозговых зон, требующих проведение курсов соответствующей ноотропной терапии.
Источник: КОГНИТИВНЫЕ НАРУШЕНИЯ У ДЕТЕЙ С ПОСТКОВИДНЫМ СИНДРОМОМ
Ишанходжаева Г.Т., Асомова Н.И.
Сборник тезисов и материалов XXIV конгресса с международным участием давиденковские чтения. Под редакцией проф. Клочевой Е.Г., проф. Голдобина В.В. СПб.: 2022. – 396 с.
В ходе проведенного анализа клинических случаев, которые представлены в данной работе, были выявлены особенности анамнеза каждого пациента (ребенка). На данный момент данная тема представляет большой интерес, так как по данным статистики, более 30% обращений к педиатру идут с жалобами на кожные высыпания. Так же, в данной работе были изучены особенности клинических проявлений синдрома экзантемы с определением показаний для дополнительных методов обследования.
В практике врача-педиатра оценка состояния кожных покровов больного ребенка всегда является важным диагностическим симптомом заболевания и критерием его тяжести. Поражение кожи и слизистых оболочек может встречаться при различных инфекционных и неинфекционных нозологиях. Экзантемы выступают одним из наиболее важных симптомов дифференциальной диагностики заболеваний. При первичном осмотре пациента врачу необходимо оценить характер высыпаний, локализацию, размеры, глубину поражения, определить причины заболевания. Своевременная диагностика синдрома экзантем позволит поставить правильный диагноз, назначить лечение, в некоторых случаях провести неотложную терапию. Это улучшит качество жизни ребенка и прогноз заболевания.
Клинический случай 1
В клинику поступил ребенок 4-х лет с целью коррекции дозы антиэпилептического препарата. Состоит на Д-учете у невролога по причине эпилепсии. Внезапное ухудшение состояния было обусловлено введением противоэпилептического препарата. В первые часы: наблюдалось ухудшение состояния: слабость, недомогание, отказ от еды, подъем температуры до фебрильных цифр, повышенная чувствительность и болезненность кожи.
Также у ребенка развились кашель, хейлит, конъюнктивит, обильные выделения из носа. Состояние больного ухудшилось с появлением генерализованной эритематозной сыпи, пятен, папул и пузырей с серозно-кровянистым компонентом. Наблюдались участки отслоения эпидермиса (симптом Никольского) и болезненность кожи. Ребенок в сознании, вялый, наблюдается тахикардия, тоны сердца ритмичные, приглушены. Живот мягкий, безболезненный. Печень выступает из-под края реберной дуги на 3 см.
Данные лабораторных и инструментальных методов исследований: на ЭКГ снижение вольтажа; общий анализ крови: анэозинофилия, сдвиг лейкоцитарной формулы влево. Биохимический анализ крови: гипо- и диспротеинемия, повышение уровня мочевины, нарушение ионного состава крови. Коагулограмма: повышение свертываемости. Общий анализ мочи: протеинурия. На основании данных анамнеза, клинических симптомов заболевания, результатов проведенных иммунологических тестов и лабораторных данных был поставлен диагноз: синдром Лайелла.
Клинический случай 2 и 3
Атопический дерматит (АД) представляет собой мультифакториальное, хроническое заболевание кожи, для которого характерно рецидивирующее течение, кожный зуд и дебют в раннем возрасте. Чаще болеют дети с отягощенной наследственностью по аллергии. Данное заболевание встречается во всех странах мира, болеют и девочки, и мальчики, старт заболевания начинается в раннем возрасте, до года. По статистике АД болеют в разных странах мира около 20-25% детей.
Пациенты поступили в клинику для лечения в период обострения. Больные имели отягощенный семейный анамнез: аллергический ринит, поллинозы, бронхиальной астмы у родителей или ближайших родственников. Кожные проявления сопровождались зудом. Симптомы атопии были уже на 1-м году жизни. Типичные локализации экзантем для раннего возраста: лицо, шея, наружная поверхность верхних и нижних конечностей, выражена экссудация, эритема, гиперемия, папулы, симметричность на кистях рук и ног, шелушение кожи. Тяжесть клинических проявлений оценивали по шкале SCORAD.
Лабораторные методы исследования: в общем анализе крови эозинофилия, повышенная концентрация IgE в сыворотке крови, резко положительные аллергологические тесты. Были проведены
консультации узких специалистов: дерматолога, аллерголога, гастроэнтеролога. Диагноз АД был выставлен на основании отягощенного аллергоанамнеза, ранней манифестации болезни, выраженного зуда кожных покровов, типичной для данного возраста локализации экзантем.
Клинический случай 4
Ребенок 4-х лет находился под наблюдением участкового педиатра. Из анамнеза стало известно, что на фоне полного благополучия внезапно появилась папулезная сыпь на лице, затем распространилась на зону декольте. Зудом не сопровождалась. Мать связывала заболевание с инсоляцией. Спустя несколько дней сыпь распространилась на конечности. Диагноз после консультации аллерголога: атопический дерматит. В течение 2 месяцев мальчик находился на гипоаллергенной диете и получал антигистаминные препараты. Состояние было без улучшений: появились слабость, раздражительность, утренняя скованность в суставах нижних конечностей, снижение массы тела на 1,5 кг, отечность лица, век, кистей. На кончиках пальцев проявления капилляритов кожи. На сгибательной поверхности ладони и 3 пальца участки некроза, на разгибательных поверхностях проксимальных межфаланговых суставов обеих кистей, коленных, локтевых суста- вов участки уплотнения. Больной был направлен в Республиканскую детскую клиническую больницу с целью диагностики заболевания и выбора тактики лечения. При поступлении в стационар эритематозные высыпания расценили как симптом Готтрона, что характерно для ювенильного идиопатического дерматомиозита (ЮИД).
У данного пациента кожные проявления были в период дебюта заболевания, мышечная слабость присоединилась позже. Диагностическими критериями ЮИД у данного пациента были: повышение уровня креатинфосфокиназы и альдолазы в сыворотке крови, положительные анти-Jo-1-антитела, наличие миогенных изменений на электронейромиографии, недеструктивный артрит. Холтеровское мониторирование – артериальное давление (АД): за время мониторинга АД согласно протоколов стандартов систолическое АД – днём от 98 до 135 мм рт.ст, диастолическое АД – днем от 71 до 105 мм рт.ст. значительно повышена вариабельность АД. Двухфазный суточный ритм АД не определяется. Тип кривой систолическое и диастолическое АД – гипертонический.
Несколько изменены показатели гемодинамики. На компьюторной томографии органов грудной клетки: в легких наличие кальцинатов в S10 слева, в этом же участке интерстициальные изменения с формированием фиброза. Умеренная лимфаленопатия средостения. Признаки системного
остеопороза. ЭЭД-1,96 м/Зв. На ФГДС: признаки эрозивной гастропатии. На рентгенографии кистей (от 09.12.2020 г.) – начальные признаки ЮРА.
Основываясь на данных анамнеза, клинического наблюдения и симптомов болезни, дополнительных методов исследования был выставлен клинический диагноз: Ювенильный идиопатический дерматомиозит, активность 2-3, подострое течение, с лихорадкой, поражением мышц, кожи.
Выводы:
Диагностика синдрома экзантем у детей, правильно собранный анамнез позволят своевременно поставить диагноз. Кожные проявления болезни могут быть симптомами заболеваний различного генеза. С целью верификации диагноза необходимо проведение дополнительных методов исследования.
Источник: ЭКЗАНТЕМЫ В СОВРЕМЕННОЙ ПРАКТИКЕ ПЕДИАТРА
Жабуро М.О., Ряпова Э.И., Лагунова Н.В., Семенчук Т.В., Кунцевич Е.И.
Международный журнал гуманитарных и естественных наук. 2023. №3-1.
DOI:10.24412/2500-1000-2023-3-1-70-72
Материал подготовлен на основании статьи: Е.В. Мелёхина1*, А.Д. Музыка1,2, М.Ю. Калугина1 , А.В. Горелов1 , О.Л. Чугунова2
1 — Клинический отдел инфекционной патологии ЦНИИ Эпидемиологии Роспотребнадзора, Москва, Россия 2 — Кафедра госпитальной педиатрии № 1 педиатрического факультета ГБОУ ВПО Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, Москва, Россия
Семейство герпесвирусов широко распространено в природе и представлено более чем 100 видами. Вирусы данной группы поражают не только человека, но и других млекопитающих, а также земноводных и пресмыкающихся. Представители семейства характеризуются пантропностью к органам и тканям, пожизненной персистенцией в организме, способностью вызывать многообразные манифестные формы.
Все герпесвирусы человека могут быть подразделены на три основных подсемейства, которые отличаются по структуре генома, тропизму к клеткам хозяина, спектру активности и способности к латенции.
Альфа-герпесвирусы включают вирус простого герпеса 1 типа (ВПГ-1), вирус простого герпеса 2 типа (ВПГ-2) и вирус ветряной оспы, они инфицируют нейроны и сохраняются в них, в то время как гамма-герпесвирусы (вирус Эпштейна-Барр (ВЭБ) и вирус герпеса человека 8 типа (ВГЧ-8)), способны инфицировать моноциты и приводить к нарушению апоптоза клеток хозяина при латентной инфекции.
Бета-герпесвирусы отличаются патогенностью, менее выраженной цитопатичностью клеток, длительным циклом репликации и пожизненной персистенцией в клетках хозяина. Они вызывают манифестную и латентную инфекции в слюнных железах, почках и других органах; могут быть причиной генерализованных поражений у новорожденных, детей и взрослых при иммунодефицитных состояниях. Патогенные для человека представители данной группы — ВГЧ-6, ВГЧ-7 и цитомегаловирус (ЦМВ) характеризуются способностью к латентной инфекции в клетках моноцитарно-макрофагальной системы и лимфоцитах. Согласно новой международной классификации, принятой в 2012 г., вирус герпеса человека 6А типа (ВГЧ-6А) и вирус герпеса человека 6В типа (ВГЧ-6В) являются самостоятельными таксономическими единицами.
Вирусы различаются по эпидемиологии, строению, времени инфицирования, клиническим проявлениям, последовательности нуклеотидов (геном идентичен в диапазоне от 75 до 95% в зависимости от сравниваемого гена. ВГЧ-6В описан как более нейровирулентный, может являться этиологическим фактором развития энцефалита, отторжения трансплантата, внезапной экзантемы. Вирусы обладают различной чувствительностью к терапии, в частности, к интерферонам (ИФН)
Особенности репликативного цикла ВГЧ-6
Репликация ВГЧ-6 является классическим вариантом репликации E-герпесвирусов, состоит из нескольких этапов. В настоящий момент определен тетрамерный комплекс вирусных лигандов (гликопротеины H, L, Q1 и Q2) благодаря которому вирус прикрепляется к клетке хозяина. После высвобождения ДНК вируса в нуклеоплазму транскрибируются гены ранних (Е) и поздних (L) антигенов вируса. Репликация генома происходит после синтеза Е белков, которые обладают ферментативной активностью для метаболизма нуклеотидов и синтеза ДНК. Дочерняя ДНК образуется в виде конкатемерных нитей (конкатемер — фрагмент ДНК, составленный из повторяющихся нуклеотидных последовательностей, соединенных «голова» к «хвосту»). Полный цикл репликации, который длится около 3 дней, оказывает серьезное влияние на функции и морфологию клетки-хозяина. Зараженные клетки, в конечном счете, погибают путем апоптоза и/или некроза. В 1993 г. Luppi и соавторы продемонстрировали присутствие полноразмерного интегрального генома ВГЧ-6 или его части в ДНК свежеизолированных мононуклеарах периферической крови. Данное состояние было обозначено как хромосомная интеграция ВГЧ-6 (хиВГЧ-6, CIHHV-6). Ковалентная связь между вирусной и клеточной ДНК возникает в субтеломерных областях хромосом, вероятно, по механизму гомологичной рекомбинации. Данный феномен был описан для ВГЧ-6А и ВГЧ-6В и встречается у 0,2-1% населения развитых стран. Он рассматривается некоторыми авторами как основной путь латенции ВГЧ-6.
Первичная инфекция может привести к накоплению вируса в организме хозяина, интеграции в его герминативные клетки и передаче потомству. Кроме того, хромосомноинтегрированный ВГЧ-6 способен к реактивации, продукции вирусных частиц, белков, и даже передаче вирионов. Это доказывает тесную связь между хромосомной интеграцией, латенцией и реактивацией. Особенности взаимодействия ВГЧ-6 с иммунной системой организма хозяин.
В момент инфицирования ВГЧ-6 инфекция способна к стимуляции эффекторов врожденного иммунитета: повышению секреции провоспалительных цитокинов, таких как интерлейкин 1, фактор некроза опухоли альфа и ИФН-D в мононуклеарах периферической крови, стимулирует выработку натуральных киллеров, связанных с интерлейкином 15, который способствует развитию инфекции. Специфический иммунный ответ к ВГЧ-6 у пациентов с первичной инфекцией проявляется наработкой специфических иммуноглобулинов M (IgM) в течение первой недели и их последующее исчезновение после 1 месяца, в то время как иммуноглобулины G (IgG) обнаруживаются позже, чем IgM, но сохраняются на неопределенный срок. Модуляция иммунных реакций позволяет ВГЧ-6 уклоняться от специфического иммунного ответа и влиять на микроокружение, создавая благоприятные условия для персистенции вируса. Например, усиление активности провоспалительных цитокинов в мононуклеарах периферической крови связано с подавлением синтеза интерлейкина 2 и последующим снижением активности Т-клеток. Соответственно, ВГЧ-6 провоцирует сдвиг Т-хелперов (Тh) с Тh1 на Th2, стимулируя интерлейкин 10 и подавляя интерлейкин 12. ВГЧ-6А инфекция подавляет экспрессию человеческого лейкоцитарного антигена (HLA) класса I в дендритных клетках. Также ВГЧ6-А инфекция обладает выраженным супрессивным эффектом на рост и дифференцировку костномозговых клеток-предшественников, которые могут влиять на дифференцировку макрофагов и популяции предшественников тимоцитов. Роль ВГЧ-6 в качестве ко-фактора вируса иммунодефицита человека (ВИЧ) и синдрома приобретенного иммунодефицита (СПИД) остается предметом дискуссии. Предположение основано на обнаруженном взаимодействии между обоими вирусами in vitro, общим тропизмом ВГЧ-6 и ВИЧ к CD4+ Т-клеткам, трансактивации ВИЧ-1 белками длинных концевых повторов (LTR-белками) ВГЧ-6, индукции экспрессии СD4 на CD8+ и NKклетках, что делает эти клетки восприимчивыми к ВИЧ-инфекции. Кроме того, ВГЧ-6-инфекция стимулирует реактивацию ВЭБ из состояния латенции, а также, как и экспрессию человеческого эндогенного ретровируса К-18. Роль генетического полиморфизма человека в развитии герпесвирусной инфекции (ГВИ) продемонстрирована при различных заболеваниях. Известно, после инфицирования Herpes zoster, чаще в детском возрасте, развивается ветряная оспа. Затем вирус может длительно оставаться латентным в нервной ткани, и иногда реактивируется на фоне иммуносупрессии и старения с развитием опоясывающего лишая.
Crosslin D.R. и соавторами выявлен регион некодирующих генов HCP5 главного комплекса гистосовместимости. Этот ген является эндогенным ретровирусом и, скорее всего, влияет на вирусную активность, что обеспечивает развитие опоясывающего герпеса. В 2014 году опубликовано сообщение о том, что связи c риском развития и рецидивирование ВПГ 1 типа-энцефалита может быть связан с дефицитом Tolllike рецепторов 3 (TLR3). Таким образом, развитие различных клинических форм ГВИ вообще, и ВГЧ-6 инфекции в частности, связано не только с особенностями самого вируса и его влияние на иммунную систему, но и генетическим полиморфизмом распознающих систем организма хозяина.
Клиническая картина
Впервые клиническая картина первичной инфекции ВГЧ-6 (внезапная экзантема) была описана американским педиатром Загорским в 1920 году и получила название детская розеола (roseola infantum) [31], а в 1921 г. американские ученые Видер и Гемпельман ввели термин — «внезапная экзантема» (exanthema subitum). Позже этиологию заболевания приписывали энтеровирусной инфекции. Однако в 1988 году Yamanishi К. было доказано, что внезапная экзантема является острой формой инфекции ВГЧ-6. С течением времени появилось много данных в зарубежной литературе о роли вируса в развитии фебрильных судорожных приступов у детей. Согласно нашим данным, острые формы ВГЧ-6 у детей в условиях инфекционного стационара протекают с развитием внезапной экзантемы, фебрильных приступов, афтозного стоматита, мононуклеозоподобного синдрома или лихорадки без очага инфекции. Более чем у половины детей с фебрильными судорожными приступами выявляются маркеры активной ВГЧ-6 инфекции в крови. На сегодняшний день считается доказанной роль ВГЧ-6 в формировании инфекционного мононуклеоза, который имеет свои клинические особенности по сравнению с инфекционным мононуклеозом, вызванным ЦМВ и ВЭБ. У детей инфекционный мононуклеоз, ассоциированный с ВГЧ 6 типа, характеризуется непродолжительной фебрильной лихорадкой, умеренно выраженными симптомами интоксикации, умеренной лимфоаденопатией, ангиной, с наложениями или без таковых, умеренным увеличением печени, и, в половине случаев, селезенки. У трети больных возникает сыпь. Основными гематологическими изменениями в клиническом анализе крови являются умеренный лейкоцитоз, на первой неделе часто нейтрофильного характера, лимфомоноцитоз в разгаре болезни, тромбоцитоз на второй неделе болезни, значительное ускорение СОЭ, а также появление атипичных мононуклеаров у половины больных на 1-2 неделе заболевания. В связи с тем, что ВГЧ-6 является близким по своему строению и свойствам к ЦМВ, играющему важную роль в формировании перинатальной патологии, обсуждается его роль в патологии плода и новорожденных. Так, Калугиной М.Ю. в 2009 году маркеры ВГЧ-6 были обнаружены в органах и тканях детей, умерших от тяжелой неонатальной патологии. Наблюдалась моноинфекция, а также сочетание с ВЭБ, ЦМВ, вирусом краснухи. Антигены ВГЧ-6 определялись значительно чаще, чем антигены других герпесвирусов, выявлялись в сердечной мышце, печени и головном мозге. Проведенные исследования показали роль ВГЧ-6 и других герпесвирусов в неонатальной патологии детей.
Передача вирусов от матери к ребенку возможна как за счет реализации трансплацентарного пути передачи инфекции, так и при прохождении плода по родовым путям. Caserta M.T. и соавторы в 2014 году провели исследование, целью которого была оценка влияния врожденной инфекции ВГЧ-6 на интеллектуальное и психомоторное развитие детей первого года жизни. Наблюдались 299 детей с периода новорожденности до 2,5 лет. Было установлено, что врожденная инфекция ВГЧ-6 не оказывает влияния на интеллектуальное развитие и может вызывать негрубую задержку психомоторных навыков. Врожденная инфекция ВГЧ-6 обнаруживается у 1% новорожденных и часто протекает бессимптомно. По некоторым данным, среди пациентов с врожденной инфекцией преобладает хромосомноинтегрированный ВГЧ-6. Однако в литературе описана роль вируса в развитии афебрильных неонатальных судорог (ВГЧ-6В), тяжелой органной патологии и гибели новорожденных, а также негативное влияние на дальнейшее неврологическое развитие ребенка.
После первичного попадания в организм, ВГЧ-6 способен длительно находиться в латентном состоянии и вызывать генерализованную инфекцию при снижении иммунной реактивности организма. Поэтому наиболее тяжелые, связанные с поражением нервной системы, формы заболевания развиваются у больных после трансплантации органов, пациентов с гемобластозами, ВИЧ-инфицированных.
Описаны гемофагоцитарный синдром, гастроэнтерит, колит, миокардит, менингоэнцефалит и энцефалит. Хроническая инфекция у взрослых может выступать триггером в развитии таких заболеваний, как рассеянный склероз и синдром хронической усталости, лекарственно-индуцированный синдром гиперчувствительности (DRESSсиндром).
У детей хроническое течение с формированием вторичного иммунодефицитного состояния проявляется рецидивирующей инфекцией ЛОР-органов, лимфопролиферативным синдромом, длительным субфебрилитетом. Более чем у половины детей с рецидивирующими заболеваниями респираторного тракта (инфекционный индекс более 1,1) выявляются хронические персистирующие ГВИ, треть из которых — ВГЧ-6.
Таким образом, на сегодняшний день нет сомнения в том, что ВГЧ-6 типа играет этиологическую роль в развитии ряда острых инфекционных состояний, патологии нервной системы. Учитывая то, что, как все E-герпесвирусы, он имеет способность к длительному персистированию, актуальной проблемой является разработка клинико-диагностических критериев для выявления хронических форм инфекции ВГЧ-6.
Диагностика
Современная диагностика инфекции ВГЧ-6 базируется на комплексных методах определения антигенов вируса и антител к ним. Наиболее трудны для диагностики персистирующая и латентная формы инфекции. Общепринято обнаружение ДНК ВГЧ-6 в лимфоцитах периферической крови или в других тканях методом гибридизации (полимеразная цепная реакция, ПЦР). Наиболее чувствительным методом для диагностики первичной инфекции (около 90%) является детекция ДНК ВГЧ-6 в плазме и определение титра вирусной нагрузки количественным методом, однако это может свидетельствовать и о реактивации хронической инфекции. ПЦР с использованием обратной транскриптазы, разработанная недавно, позволяет надежно дифференцировать латентную инфекцию ВГЧ-6 и реактивацию инфекции. Существует целый ряд серологических методов определения ВГЧ-6-инфекции: иммунофлюоресцентный метод, иммуноферментный анализ (ИФА), иммуноблот, иммунопреципитация. Наиболее часто используется ИФА, однако он имеет целый ряд недостатков и редко помогает в диагностике клинической манифестации. Определение титра специфических IgM используют для диагностики острой инфекции или реактивации. Однако не у всех детей, переносящих первичную инфекцию, отмечается продукция антител IgM, а приблизительно 5% здоровых взрослых имеют антитела IgM к ВГЧ-6. В связи с тем, что практически у всех взрослых выявляют IgG к ВГЧ-6, обнаружение специфических антител в одном образце незначимо. К тому же, повышение их титра не позволяет дифференцировать первичную инфекцию от реактивации. Возможно также выявление перекрестно реагирующих антител к другим ДНК вирусам, особенно ВГЧ-7, в силу схожести геномов на 42,5%. Доступные в настоящий момент серологические тест-системы не позволяют дифференцировать варианты А и B ВГЧ-6. У детей диагноз первичной инфекции ВГЧ-6 требует обнаружения виремии (изоляции ВГЧ-6 в моноядерных клетках периферической крови) и 4-х кратного нарастания серологических тестов. Виремия наблюдается относительно редко у здоровых детей по сравнению с детьми, переносящими первичную инфекцию. Изоляция ВГЧ-6 требует культивирования на чувствительных клетках in vitro и последующей идентификации на оборудовании, которое доступно только исследовательским лабораториям.
Наличие только антител класса IgG (ИФА) к ВГЧ-6 в средних (1:250 — 1:500) и высоких титрах (IgG в титре ≥ 1:500) свидетельствует о не так давно перенесенной инфекции; наличие только антител класса IgG к ВГЧ-6 в низких титрах — свидетельствует о том, что у ребенка был контакт с вирусом и организм ответил слабовыраженной иммунной реакцией. Присутствие антител класса IgG к ВГЧ-6 в низких титрах при наличии антигенов или ДНК свидетельствует о развитии заболевания в латентной форме, либо в острой, но при слабой наработке организмом антител (дети с иммунодефицитными состояниями различной природы); присутствие антител класса IgG к ВГЧ-6 в высоких титрах в сочетании с обнаружением антигенов или ДНК, свидетельствует об острой стадии заболевания (как при первичном инфицировании, так и на стадии реактивации инфекции). Следовательно, только комплексный анализ полученных результатов позволяет правильно определить стадию заболевания и подбирать рациональную терапию.
Терапия
Терапия инфекции, ассоциированной с ВГЧ-6, до сих пор не стандартизирована, подходы к лечению отличаются в зависимости от региона, возраста пациентов, клинических проявлений. На современном этапе подходы к терапии ГВИ и, в частности, инфекции ВГЧ-6, складываются из двух подходов: прямого противовирусного воздействия и иммуномодулирующей терапии. Из препаратов прямого противовирусного действия в педиатрической практике в России разрешены ацикловир, ганцикловир и инозин пранобекс (с 3-х лет). Показанием к назначению этой терапии является лабораторно или клинически подтвержденная активная форма инфекции в стадии репликации вируса. Однако неспецифичность клинических проявлений ГВИ позволяет говорить об активной репликации вируса только в случае высыпаний при ветряной оспе и инфекции ВПГ-1 типа. Во всех остальных случаях требуется быстрое лабораторное подтверждение диагноза герпесвирусной инфекции с установлением стадии процесса, что не всегда выполнимо в реальных клинических условиях.
За рубежом для терапии ВГЧ-6–инфекции широко применяются препараты нуклеозидов и их аналоги: ганцикловир, валацикловир, фоскарнет, цидофовир. Ацикловир обладает более низкой активностью против ВГЧ-6, чем ганцикловир (от 2 до 48 раз). Ганцикловир более активен в отношении ВГЧ-6А, чем ВГЧ-6В. Однако эти лекарства имеют ряд побочных эффектов и противопоказаний, что ограничивает их использование, кроме того, у ряда пациентов описана лекарственная резистентность. Причинами резистентности могут быть частое и нерациональное применение препаратов, наличие иммунодефицита, заражение резистентным штаммом вируса. Это явление обусловлено генетически. Например, устойчивость ВГЧ-6 к ганцикловиру опосредуется мутациями в U69 и/или U38 генов. Восприимчивость ВГЧ-6 к противовирусным препаратам может быть определена в первичных лимфоцитах (периферической и пуповинной крови) и в человеческих Т-лимфобластных клеточных линиях].
В педиатрии из препаратов аномальных нуклеозидов разрешен только ацикловир (с рождения). В России для терапии инфекции, ассоциированной с ВГЧ-6, применяются препараты, влияющие на систему интерферона. Интерфероны являются гуморальными факторами врожденного звена иммунитета. ИФН-D2E оказывает противовирусный эффект в первые часы после заражения, стимулирует активность эффекторных клеток, участвуя в запуске каскада адаптивного иммунитета и формирования долгосрочной иммунной защиты против ГВИ. Препараты данной группы успешно применяются ректально как у взрослых, так и у детей. В результате лечения было отмечено снижение вирусной нагрузки, положительная динамика лабораторных показателей, иммуномодулирующее действие, в то время как побочные эффекты не были зарегистрированы.
Среди препаратов группы интерфероноиндукторов наибольшую доказательную базу по терапии ГВИ в острой и хронической форме имеет препарат Циклоферон, разрешенный в детской практике с 4 лет. Кроме воздействия на индукцию быстрого ИФН-D, он имеет уникальный противовирусный эффект, за счет образования дефект-интерферирующих частиц. В результате происходит постепенная потеря клетками организма хозяина вирусного генома и прекращение персистенции вируса. Перспективным направлением терапии ГВИ считаются ингибиторы активности ферментного комплекса геликазы-параймазы. Он является одним из компонентов системы репликации ДНК герпесвирусов и состоит из UL5 (геликазы), UL52 (праймазы) и UL8 . Комплекс геликазы-праймазы не только необходим для раскручивания ДНК и синтеза праймеров при репликации вируса, но и может быть мишенью для противовирусной терапии. Новые препараты способны не только ингибировать репликацию вируса, но и отсрочить возникновение резистентных штаммов. При исследовании in vitro показан синергизм препаратов нуклеозидов и ингибиторов геликазы-праймазы. Один из препаратов новой группы (ASP2151) находится сейчас в стадии клинических испытаний для перорального лечения опоясывающего герпеса (в Японии) и рецидивирующего генитального герпеса (в США).
Таким образом, терапия ГВИ должна быть комплексной и основываться на лабораторном подтверждении стадии процесса и типа инфекции (ВГЧ-6А и ВГЧ-6В). Для определения эффективности проводимой терапии и формирования дальнейшей тактики
Заключение
Таким образом, дальнейшее изучение герпесвирусных инфекций и их взаимосвязи с иммунной системой человека, полиморфизма клинических проявлений, позволяет совершенствовать раннюю диагностику и дифференциальную диагностику патологических состояний, связанных с воздействием герпесвирусов, а также разработать дифференциальные подходы к терапии в зависимости от стадии инфекции.
Материал подготовила врач ультразвуковой диагностики
Литвинова Г.В.
Функциональное заболевание желудочно-кишечного тракта, сопровождающееся моторно-эвакуаторными нарушениями. Синдром раздражённого кишечника у детей характеризуется болями в животе, уменьшающимися после дефекации, урчанием, метеоризмом, частыми позывами на дефекацию и ощущением неполного опорожнения кишечника, чередованием поносов и запоров. Диагностика синдрома раздражённого кишечника у детей проводится путем исключения органической патологии с помощью УЗИ брюшной полости, ирригоскопии, ЭГДС, колоноскопии, анализа кала на яйца гельминтов и пр. Лечение включает коррекцию питания, назначение спазмолитиков, ветрогонных, седативных, противодиарейных или слабительных препаратов, энтеросорбентов.
Причины синдрома раздраженного кишечника у детей
В этиологии синдрома раздраженного кишечника у детей играют роль различные факторы, к числу которых относятся наследственность, психоэмоциональные феномены, характер питания, нарушения моторики, реакции воспаления и др.
О значении наследственной предрасположенности свидетельствует тот факт, что у 33% детей родственники страдают синдромом раздраженного кишечника, а у монозиготных близнецов заболевание встречается чаще, чем у разнояйцовых (гетерозиготных). Замечено, что примерно у трети детей с синдромом раздраженного кишечника возникновение первых симптомов заболевания и обострения тесно связаны с психотравмирующими ситуациями. Ещё не менее чем в 30-40% случаев манифестация синдрома раздраженного кишечника у детей наступает после перенесённой острой кишечной инфекции, а хронизации заболевания способствует антигенная агрессия в отношении энтериновой системы. Следствием воспаления, нарушения иннервации и перерастяжения мышц кишечной стенки служит гиперрефлексия - повышенная чувствительность, когда на все раздражители (увеличение объема поступающей пищи, расширение кишки газом и т. д.) возникает болевая реакция.
Нарушение кишечного транзита при синдроме раздраженного кишечника у детей может быть обусловлено ригидностью, спастичностью кишки, дефицитом пищевых волокон в рационе ребенка, дисбактериозом, гиподинамией и пр.
Наблюдения показывают, что синдром раздраженного кишечника чаще встречается у детей с перинатальной энцефалопатией, рано переведенных на искусственное вскармливание; страдавших гипотрофией на 1-ом году жизни; перенесших энтеровирусные и ротавирусные инфекции, лямблиоз, гельминтозы; нарушающих режим питания.
Классификация синдрома раздраженного кишечника у детей
В зависимости от преобладающих клинических проявлений выделяют 4 основных варианта синдрома раздраженного кишечника у детей:
СРК с преобладанием запоров – из общего количества испражнений >25 % кала имеет твёрдую или шероховатую консистенцию и
СКР с преобладанием диареи - из общего количества испражнений >25 % кала имеет кашицеобразную или водянистую консистенцию и
смешанный СРК - из общего количества испражнений >25 % кала имеет водянистую консистенцию и столько же – твердую;
неклассифицируемый СРК – на основании выделенных критериев не может быть отнесён ни к одному из вышеперечисленных вариантов.
Симптомы синдрома раздраженного кишечника у детей
Синдром раздраженного кишечника у детей, протекающий с явлениями диареи, характеризуется отсутствием жидкого стула в ночные часы и возникновением преимущественно по утрам, после завтрака. Императивные позывы на дефекацию возникают 3-4 раза за короткий промежуток времени. Первая порция испражнений имеет, как правило, оформленный характер; при последующих актах дефекации стул приобретает кашицеобразную или жидкую консистенцию. Диарея нередко сопровождается спастическими болями в правой подвздошной области.
Вариант синдрома раздраженного кишечника у детей с преобладанием запора характеризуется нерегулярным опорожнением кишечника (реже 3-х раз в неделю), необходимостью натуживания при дефекации, чувством неполного освобождения кишечника. Стул ребенка имеет вид «ленты» или комочков. Запоры могут носить постоянный или периодический характер, либо чередоваться с диареей.
При неклассифицируемой форме синдрома раздраженного кишечника у детей отмечаются различные симптомы без явного преобладания - чередование поносов и запоров, метеоризм, урчание и чувство распирания в животе, болевой абдоминальный синдром.
Для постановки диагноза синдрома раздраженного кишечника необходимо, чтобы данные симптомы сохранялись у ребенка не менее 3-х месяцев.
Внекишечные проявления синдрома раздраженного кишечника у детей могут включать дисфагию, изжогу, тошноту. Дети пубертатного возраста предъявляют жалобы на головные боли, сердцебиение, утомляемость, дискомфорт за грудиной, нехватку воздуха, потливость, бессонницу. Часто отмечаются невротические реакции: мнительность, тревожность, раздражительность, импульсивное поведение. У 25-30% детей синдром раздраженного кишечника сочетается с дискинетической диспепсией, нейрогенным мочевым пузырем.
Диагностика синдрома раздраженного кишечника у детей
Диагностировать синдром раздраженного кишечника у ребенка довольно не просто; для этого требуется консолидация усилий детских специалистов различных профилей: педиатра, детского гастроэнтеролога, детского колопроктолога, детского невролога, детского эндокринолога и др. Диагностическая тактика основывается, главным образом, на исключении органических заболеваний ЖКТ. В связи с этим после оценки жалоб больного и физикального обследования устанавливается связь клинической манифестации синдром раздраженного кишечника у детей с ОКИ, стрессовыми ситуациями, сменой питьевой режима и характера питания.
Из методов лабораторной диагностики применяются исследования клинического и биохимического анализа крови; кала на скрытую кровь, лямблии и яйца гельминтов, копрограмму; бакпосев кала на кишечную группу, анализ на дисбактериоз. В порядке скрининга проводится УЗИ органов брюшной полости ребенку и ультрасонография толстого кишечника.
С целью исследования моторно-эвакуаторной функции толстого кишечника выполняется ирригография, выявляющая в дистальных отделах участки спазмированной кишки. Эндоскопия у детей (ректороманоскопия, колоноскопия) может обнаруживать поверхностные катаральные изменения слизистой оболочки толстой кишки. Эндоскопическая биопсия позволяет исключить подозрение на неспецифический язвенный колит и болезнь Крона. При необходимости исследования верхних отделов ЖКТ проводится ЭГДС, рентгенография желудка с барием.
Оценить моторную функцию толстой кишки при синдроме раздраженного кишечника у детей помогают колодинамические исследования – энтероколосцинтиграфия, аноректальная манометрия.
Комплексный и индивидуализированный подход позволяет провести дифференциальную диагностику синдрома раздраженного кишечника у детей с мегаколоном, колитом, паразитозами, лактазной недостаточностью, целиакией и другой структурной и биохимической патологией.
Лечение синдрома раздраженного кишечника у детей
Лечения синдрома раздраженного кишечника у детей проводится дифференцированно, с учетом клинической формы заболевания. Во всех случаях осуществляется коррекция рациона ребенка с учетом возраста и ведущих симптомов (диареи, запора, метеоризма). Диетический режим предполагает дробный прием пищи 5–6 раз в сутки; исключение из питания животных жиров, шоколада, молока, капусты, бобовых, черного хлеба, газированных напитков. Важную роль играет нормализация психологического микроклимата в семье и школе, водные процедуры, достаточная физическая активность, занятия ЛФК, выработка навыков ежедневной дефекации.
При синдроме раздраженного кишечника с запорами детям назначаются слабительные (препараты лактулозы), прокинетики (домперидон), пре- и пробиотики. В случае преобладания диарейного синдрома показаны энтеросорбенты (смекта, полифепан), кишечные антисептики (фуразолидон, интетрикс), ферменты (панкреатин, креон и др.), антидиарейные (имодиум, лоперамид), пре- и пробиотические препараты. В терапии смешанного и неклассифицируемого вариантов синдрома раздраженного кишечника у детей применяются спазмолитики (бускопан), ветрогонные средства (эспумизан), пробиотики (линекс, бифиформ), пребиотики (хилак-форте, дюфалак), ферменты. Психотерапевтическая коррекция проводится по назначению детского психоневролога.
При гипермоторной дисфункции ЖКТ ребенку с синдромом раздраженного кишечника могут назначаться грязевые, озокеритовые или парафиновые аппликации на живот, СМТ-терапия, электрофорез, рефлексотерапия; в случае гипомоторной дискинезии – дарсонвализация и электростимуляция на область живота, массаж передней брюшной стенки.
Прогноз и профилактика синдрома раздраженного кишечника у детей
Внимание к проблеме синдрома раздраженного кишечника у детей позволяет предотвратить его хронизацию. Профилактические мероприятия носят неспецифический характер и включают предупреждение и адекватное лечение ОКИ, создание комфортной психосоциальной обстановки вокруг ребенка, соблюдение режима и принципов рационального питания, достаточной физической активности.
Подготовила врач ультразвуковой диагностики
Кузнецова Н.И.
Черепно-мозговая травма (ЧМТ) - повреждения черепа, головного мозга, мозговых оболочек, сосудов и/или черепно-мозговых нервов сопровождающиеся клинической симптоматикой и в большинстве случаев морфологическими изменениями. Крайне важным является наличие четкого травматического анамнеза.
Легкая ЧМТ (ЛЧМТ) – остро развившееся нарушение функции мозга, являющееся следствием травматического воздействия, при котором может отмечаться кратковременная потеря сознания (до 30 минут) и/или амнезия (до 24 часов). Она включает в себя две нозологии: сотрясения головного мозга и ушиб мозга легкой степени тяжести. Сотрясение головного мозга (СГМ) - наиболее лёгкая клиническая форма диффузного транзиторного повреждения мозга, в основе которого лежат метаболические, ионные, нейротрансмиттерные нарушения и нейровоспаление, характеризующаяся отсутствием видимых изменений на компьютерной томографии (КТ).
Лёгкая черепно-мозговая травма (ЛЧМТ) доминирует в структуре черепномозгового травматизма – 60-95% всех пострадавших Соотношение распространенности ЛЧМТ по отношению к тяжелой составляет 22:1. Соотношение сотрясения головного мозга и ушиба лёгкой степени тяжести примерно 4:1. По течению травматической болезни головного мозга выделяют периоды: 1) острый, 2) промежуточный, 3) отдаленный.
Сотрясение головного мозга характеризуется нарушением сознания после травмы от нескольких секунд до нескольких минут, ретро-, кон-антероградной амнезиями на короткий период времени (от нескольких минут до 1 часа) (30-50% случаев) наличием преимущественно субъективной симптоматики. Нарушения сознания отмечаются примерно у 90% пациентов с сотрясениями мозга. При этом, у 70% отмечается кратковременная утрата сознания в момент травмы. Может наблюдаться головная боль, головокружение несистемного характера, тошнота, рвота преимущественно однократная, общая слабость, быстрая утомляемость, шум в ушах, светобоязнь, вегетативные симптомы: бледность или гиперемия кожных покровов и слизистых, гипергидроз ладоней и стоп, нарушение дермографизм, артериальная гипертензия, артериальная гипотензия, тахикардия, брадикардия, а также нарушение сна, боли при движении глазных яблок, нарушение конвергенции, эмоциональная лабильность. У большинства пациентов восстановление после ЛЧМТ происходит в короткие сроки (в течение 1-2 недель), однако у 5-30% пострадавших могут отмечаться более длительные (до нескольких месяцев) физические, когнитивные, эмоциональные и поведенческие расстройства, которые носят название постконтузионного синдрома. Сроки регресса клинической симптоматики у подавляющего большинства пострадавших детей с СГМ составляют в среднем 4 - 5 суток.
В неврологическом статусе могут выявляться мелкоразмашистый нистагм, негрубая анизорефлексия сухожильных и кожных рефлексов, статическая атаксия, динамическая атаксия, повышение сухожильных рефлексов, легкие оболочечные симптомы, исчезающие у 90% пациентов в течение первых 4-5 суток. Повреждения костей черепа отсутствуют. Общее состояние пострадавших детей обычно значительно улучшается в течение первой, реже — второй недели после травмы независимо от определенной неврологической симптоматики.
Пострадавшим детям с СГМ рекомендовано проведение КТ головного мозга при наличии факторов риска. Рекомендовано выявить факторы риска: рвота, посттравматические судороги, подозрение на открытый или вдавленный перелом черепа, посттравматическая амнезия более 4 часов, клинические признаки повреждения основания и свода черепа, опасный механизм травмы. При невозможности провести КТ головного мозга рекомендовано проведение рентгенографии черепа в 2-х проекциях для исключения перелома черепа и эхоэнцефалоскопии.
Поскольку семиотика сотрясения головного мозга очень мягкая и может наблюдаться вследствие самых различных дотравматических причин, исключительное значение для диагностики приобретает динамика признаков. Их обычное исчезновение через 3-5 суток способствует подтверждению диагноза сотрясения мозга. Рекомендуется для объективизации диагноза сотрясения головного мозга офтальмоскопия на 1-3 сутки, при которой у 90% пациентов могут быть выявлены изменения на глазном дне в виде спазма артерий сетчатки, венозного полнокровияили артериоспазма на фоне венозного полнокровия.
Распознавание сотрясения головного мозга у детей часто представляет непростую задачу, т.к. основано преимущественно на субъективной симптоматике. В диагностике сотрясения мозга особенно важно оценивать обстоятельства травмы и информацию свидетелей происшедшего. Двоякую роль могут играть следы травмы на голове. Несмотря на отсутствие симптоматики, данные КТ имеют решающее значение в подтверждении диагноза ЛЧМТ и диагностике отсроченно возникающих интракраниальных субстратов повреждения.
Лечение включает медикаментозную и немедикаментозную терапию, диетотерапию, обезболивание. Установлено, что сам по себе факт госпитализации ребенка без отягощённого преморбида не оказывает какого-либо существенного влияния на течение и исходы этой формы ЧМТ, поэтому, с учётом всех обстоятельств допустимо детей с СГМ также лечить на дому. Родителей ребенка необходимо предупредить, что при ухудшении состояния ребенка, необходим срочный повторный врачебный осмотр. Рекомендуется после начального периода покоя постепенное возвращение ребенка к нормальной повседневной активности. Не рекомендуется активность, связанная с рисками повторной травмы мозга до полного клинического восстановления, которое характеризуется полным регрессом симптомов, нормализацией данных физикального обследования, возвращением к обычной повседневной деятельности. Не рекомендовано назначение противосудорожных средств с профилактической целью. Рекомендуется в первую очередь немедикаментозное лечение головной боли: нормализация сна, регулярное питание, достаточный питьевой режим, исключение стрессовых факторов, умеренная физическая нагрузка. Для лечения нарушений сна рекомендуются в первую очередь немедикаментозные мероприятия: соблюдение режима отхода ко сну, исключение дневного сна, еды и напитков со стимулирующим эффектом или когнитивной поведенческой терапии.
Прогноз при СГМ обычно благоприятный: субъективная и объективная симптоматика сравнительно быстро исчезает и функциональные возможности пострадавшего ребенка полностью восстанавливаются. Рекомендуется динамическое наблюдение невролога с оценкой общего состояния и неврологического и психического статуса в динамике в сроки 1, 3 и 6 мес. после СГМ.
Подготовила врач-невролог Котова О.С.
Редкие заболевания получили название «орфанные» (от англ. orphan — сирота) в связи с тем, что какое-то время назад фармкомпании были не заинтересованы в разработке лекарств для них, наподобие тому, как сироты остаются без опекуна. Этот термин был введен в рамках закона об орфанных лекарственных препаратах Orphan Drug Act of 1983, принятого в США с целью стимулирования исследований и разработки лекарств для редких заболеваний. Как правило, термины «редкие заболевания» и «орфанные заболевания» взаимозаменяемы. К ним относятся такие заболевания, от которых страдает не более 10 пациентов на 100 тысяч граждан. По последним оценкам насчитывается около 7000 редких заболеваний. Несмотря на это, утвержденный в РФ перечень (который, впрочем, периодически пополняется), содержит всего-навсего 267 таких болезней. В РФ также существует «Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности», в который входит 24 позиции. И если каждое конкретное редкое заболевание может затрагивать совсем немного людей, то в сумме во всем мире от всех редких заболеваний страдает около 300 миллионов человек, т.е. ~5% населения. Это значит, каждый двадцатый человек болеет орфанным заболеванием. Интересно, что большая часть людей с орфанными заболеваниями страдает от не таких уж редких болезней: 1 случай на 5–10 тысяч человек. Однако более 80% орфанных заболеваний и в самом деле очень редки: менее 1 случая на миллион. Ситуация отягощается тем, что ~70% орфанных заболеваний генетические, а, значит, хронические, прогрессирующие и чаще всего — неизлечимые. Около ⅔ из них проявляются в детском возрасте. Симптоматика редких заболеваний часто сбивает с толку даже опытных специалистов, ведь они зачастую похожи на более распространенные болезни. Несмотря на многочисленность редких заболеваний, от каждого из них отдельно страдает относительно малое число людей. В России создано Всероссийское общество орфанных заболеваний (ВООЗ), учредители которого собирают информацию и проводят конференции, посвященные орфанным заболеваниям. В целом, в разных странах можно найти пациентские группы, созданные людьми с определенным заболеванием.
Редко – не значит никогда. Нам еще только предстоит узнать, насколько на самом деле редки орфанные заболевания. Однако уже понятно, что в целом с ними сталкивается множество людей. Часто непонятно, что происходит с ребенком, годами родители скитаются по врачам в поисках причины недуга своего ребенка. Они полностью разочаровываются в системе здравоохранения и отчаиваются, когда понимают, что для лечения заболевания их ребенка лекарства не существует.
Выявить болезнь можно с помощью скрининга, который может проводиться на разных этапах жизни. Самый массовый скрининг – неонатальный, который сегодня охватывает практически всех новорожденных, которые появляются на свет в России. Он проводится в России с 1993 года. Тогда младенцев проверяли только на 2 заболевания: фенилкетонурию и врожденный гипотиреоз, в 2006 году список увеличился до 5 болезней – добавили муковисцидоз, галактоземию и адреногенитальный синдром. В 2023 году перечень патологий был существенно расширен: вместо 5 болезней теперь в него входит 36 наследственных заболеваний, в числе которых спинальная мышечная атрофия (СМА), первичные иммунодефициты, наследственные болезни обмена. Такое исследование проводится во всех российских регионах. У доношенных младенцев на второй день жизни из пяточки берут кровь для анализа, взятые образцы на одном бланке отправляются для скрининга «классических» пяти нозологий, на другом доставляются в центр расширенного скрининга. В России таких центров 10.
Выявить болезнь можно не только сразу после рождения, но и в более взрослом возрасте – с помощью селективного скрининга. Он проводится при появлении у пациента подозрительных симптомов, указывающих на редкую болезнь.
Как лечат орфанные болезни? В отечественном списке редких болезней около 260 состояний. Эксперты V Всероссийского форума по орфанным заболеваниям отмечают, что сейчас нет четких клинических рекомендаций по лечению и реабилитации пациентов с каждой из них. Из-за этого далеко не все могут получить нужную им терапию. Это нередко связано с высокой ценой необходимых лекарств. В России государство обеспечивает лекарствами пациентов с заболеваниями, внесенными в «Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности», а также в программу «14 высокозатратных нозологий». Сейчас российские фармацевтические компании занимаются разработкой отечественных аналогов 189 зарубежных орфанных препаратов. Это позволит улучшить лекарственное обеспечение пациентов, которые нуждаются в препаратах, закупаемых по программе «14 высокозатратных нозологий». Среди заметных достижений российских фармпроизводителей – клинические испытания отечественного препарата от СМА, которые сейчас проводит BIOCAD, а также создание Федеральным медико-биологическим агентством (ФМБА) прототипа аналога «Золгенсмы». Напомним, что зарубежные препараты для лечения спинальной мышечной атрофии, считаются одними из самых дорогих в мире. Отечественный аналог, при условии прохождения клинических испытаний, может сделать терапию гораздо более доступной. Также в работе находится препарат от редкого и тяжелого наследственного заболевания – миодистрофии Дюшенна. Его совместную разработку Марийский государственный университет в Йошкар-Оле и Институт теоретической и экспериментальной биофизики РАН в подмосковном Пущино. Одна из причин того, что далеко не все больные получают нужные им лекарства, связана в том числе и с тем, что реестра, который учитывал бы всех пациентов с орфанными болезнями, нет. По разным статистическим данным число таких больных в России составляет от 300 тысяч до нескольких миллионов. Большинство орфанных заболеваний вылечить нельзя, так как пока невозможно исправить генетическую поломку в ДНК. Но обнаруживать их как можно раньше важно и нужно: это позволяет своевременно начать лечение, а значит снизить риск развития осложнений, улучшить качество жизни и увеличить ее продолжительность. Терапия бывает разной. В некоторых случаях приходится серьезно менять питание, в других нужно пожизненно принимать лекарственные препараты. Каждый год обнаруживают новые орфанные болезни, регулярно появляются и новые подходы к их терапии. Некоторые болезни сегодня перестали быть смертельным приговором и перешли в разряд хронических, но все равно проблем, с которым сегодня сталкиваются пациенты с редкими заболеваниями, немало.
Подготовила врач-невролог Котова О.С.
Джо́н Бо́улби (Эдвард Джон Мостин Боулби; 26 февраля 1907— 2 сентября 1990)— английский психиатр и психоаналитик, специалист в области психологии развития, психологии семьи, психоанализа и психотерапии, основоположник теории привязанности.
Учился в школе для одарённых детей. Высшее образование получил в Кембриджском университете. В течение года работал в школе для трудновоспитуемых детей. В годы Второй мировой войны работал военным психиатром. С 1946года работал в Тавистокской клинике, где руководил отделом детей и родителей. На протяжении ряда лет занимался практической психиатрией и психоанализом.
Секретарь Британского психоаналитического общества. Исполняющий обязанности президента Научного общества. Председатель Ассоциации детской психологии и психиатрии Президент Международной ассоциации детской психологии и психиатрии. Член редколлегии журнала «Journal of Child Psychology and Psychiatry».
Исследовательская деятельность
Исследовал роль семьи в жизни ребёнка, влияние разлуки с матерью на развитие ребёнка, взаимосвязь отсутствия материнской любви и психопатологических отклонений, фазы протеста, отчаяния и отторжения, сепарационную тревогу, беспокойство, депрессию, проблемы защиты, насилия.
Был одним из первых, кто понял, что для ребёнка жизненно важна привязанность к одному взрослому, который о нем заботится. Эта привязанность обусловлена эволюционно и обеспечивает биологическую и психологическую защиту ребёнка.
Тео́рия привя́занности Бо́улби
Тео́рия привя́занности Бо́улби (англ. theory of attachment), психологическая теория, которая постулирует, что в процессе диадического взаимодействия «ребёнок – взрослый» в период от 0 до 36 месяцев у ребёнка вырабатывается индивидуальная система поведения привязанности и закрепляется в виде представления о себе, других и окружающем мире. Понятие «привязанность» в теории Дж. Боулби охватывает все аспекты отношений в диаде «ребёнок – ухаживающий взрослый».
Основным автором теории является Дж. Боулби, разрабатывавший её в 1958–1982 гг.. Наряду с Боулби значимый вклад в теорию привязанности сделан М. Эйнсворт , Р. Хайндом и другими исследователями.
Важным вкладом Боулби в теорию привязанности являются следующие сформулированные им положения:
1) система привязанности относится к поведению;
2) индивидуальные различия в системе привязанности соотносятся с индивидуальными представлениями о себе, других и окружающем мире.
Толчком к разработке теории привязанности для Боулби явились результаты изучения поведения детей и младенцев, находящихся на длительном лечении и/или на попечении государства в специализированных учреждениях. Господствующего в то время психоаналитического подхода к личности и детско-родительским отношениям было недостаточно для осмысления полученных результатов наблюдений за поведенческими особенностями таких детей, и Боулби обратился к идеям этологии и когнитивной психологии для объяснения ряда феноменов:
б) схожести процесса горевания у ребёнка и взрослого;
в) защитных реакций и процессов или избирательности стимулов, необходимых для активации поведения привязанности.
Опираясь на этологические и онтогенетические принципы и отталкиваясь от утверждения о том, что близость и связь с ухаживающим взрослым является определяющим фактором для выживания, успешной адаптации и социально-эмоционального развития ребёнка, Боулби полагает, что в результате эволюционных процессов регуляции близости и связи между младенцем и фигурой привязанности у ребёнка формируется особая мотивационная система, или система поведения привязанности. Поведение привязанности реализуется посредством сенсорных систем, когда младенец требует (использует, ищет), во-первых, информационные маркеры физической и психологической опасности, во-вторых, информационные маркеры физической и психологической доступности фигуры привязанности. В ситуациях опасности или сепарации с фигурой привязанности крик, плач и поисковая активность у младенца являются адаптационными реакциями, связанными с активацией системы поведения привязанности.
Боулби считал, что понятие «привязанность» не является простой аналогией для понятия социальной связи, и роль фигуры привязанности концептуально отличается от роли партнёра или товарища по играм. Различие состоит в том, что потребность в фигуре привязанности у ребёнка возникает в ситуации опасности и стресса, а в товарище по играм – при хорошем настроении, в стабильной, безопасной ситуации.
В то же время в многочисленных эмпирических исследованиях, посвящённых детско-родительскому взаимодействию, было показано, что родители и близкие родственники могут в разной степени сочетать в себе роли фигуры привязанности и компаньона по играм и прочим совместным действиям. Ряд авторов обнаружили, что в западных культурах мать чаще всего является доминирующей фигурой привязанности для ребёнка, а отец – товарищем по играм, а в ряде других культур совместные игры и регулярная коммуникация не являются важной частью взаимодействия в диаде «мать – ребёнок», однако мать активно демонстрирует отзывчивость и заботу в ситуациях опасности и выражения негативных реакций ребёнком.
Согласно теории привязанности Боулби, в процессе постоянных взаимодействий с миром людей и объектов ребёнок конструирует сложную внутреннюю рабочую модель окружающего его мира, значимых взрослых и себя самого в этом мире. Понятие «рабочая модель» Боулби родственно понятию ментальной модели и почерпнуто автором из книги шотландского философа и психолога К. Крейка «Природа объяснений» , а также сходно с аналогичным понятием в теории Ж. Пиаже. Прилагательное «рабочая» у Боулби описывает динамические аспекты репрезентации, позволяя объяснять реальность и оценивать перспективы для того или иного поведения, а также смену простой модели на последующую более сложную её версию.
Рабочая модель помогает ребёнку оценивать новые ситуации и служит ориентиром для выстраивания своего поведения в них, при этом оценка доступности и отзывчивости фигуры привязанности не обновляется ребёнком каждый раз. Например, если опыт ребёнка выстраивается в модель, где фигура привязанности является гарантированным источником поддержки, то постоянное наблюдение за местонахождением фигуры привязанности не становится актуальной задачей, в отличие от обратного случая, когда ребёнок не может рассчитывать на отзывчивость фигуры привязанности. Т. е. однажды сформированные рабочие модели для фигуры привязанности и самого себя в дальнейшем срабатывают автоматически, помогают ассимилировать новую информацию и являются устойчивыми к каким-либо существенным изменениям. По мере взросления ребёнка поведение привязанности становится заметно лишь в стрессовых ситуациях.
Подробное описание своей теории привязанности Боулби опубликовал в трёхтомнике «Привязанность и потеря» в 1969–1980 гг.
Материал подготовила медицинский психолог Пантелеева Э.В.
По материалам статьи
С.О. Тебердиева, Л.В. Ушакова, Е.А. Филиппова, В.Г. Быченко, Е.И. Дорофеева, А.А. Буров, Д.Н. Дегтярев
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, Москва, Россия Diagnostic value of neuroimaging techniques in newb
В структуре младенческой смертности аномалии развития занимают третье место. Современные успехи реаниматологии, неонатологии и детской хирургии в последние десятилетия определили возможность оказания неотложной помощи новорожденным детям с тяжелыми пороками развития. Тяжесть состояния таких детей при рождении зачастую обусловлена легочно-сердечной недостаточностью, нестабильной гемодинамикой, что повышает риск перинатального поражения ЦНС. Традиционно в качестве основного метода ранней диагностики структурных поражений головного мозга у новорожденных детей используется нейросонография. Широкое применение этого метода связано с общедоступностью, безопасностью и малой инвазивностью. Метод бесценен в диагностике поражений головного мозга у детей, находящихся в отделении реанимации, транспортировка которых для проведения магнитно-резонансной томографии (МРТ) невозможна в связи с тяжестью состояния.
Более точная информация о наличии и характере структурных изменений ЦНС может быть получена на основании МРТ. Помимо более высокой степени детализации анатомических структур головного мозга, этот метод характеризуется отсутствием лучевой нагрузки на организм, возможностью исследования в различных плоскостях, не перемещая пациента, и высоким тканевым контрастом. Кроме того, МРТ является стандартизованным воспроизводимым методом, что делает его более объективным по сравнению с другими видами нейровизуализации, включая нейросонографию. Недостатком метода является необходимость специальной подготовки пациента (транспортировка, дополнительная медикаментозная седация, необходимость магнит-совместимого кувеза для критически тяжелых новорожденных и др.) и существенно более высокая стоимость. Как правило, показанием к данному исследованию является неврологический статус ребенка в совокупности с данными лабораторно-инструментальных методов обследования. Накопленный в Научном центре акушерства, гинекологии и перинатологии имени В.И. Кулакова опыт дополнительного обследования новорожденных в пред- и послеоперационном периодах позволяет выяснить частоту структурных поражений ЦНС у детей с врожденными пороками внутренних органов и уточнить клиническую информативность каждого из используемых методов.
Цель исследования: установить частоту и характер поражений головного мозга методами нейровизуализации, определяющими транзиторные и необратимые поражения функции ЦНС у новорожденных детей с пороками развития внутренних органов в периоперационном периоде.
Характеристика детей и методы исследования
Для достижения поставленной цели проанализированы 243 истории болезни детей с врожденными пороками внутренних органов. Все дети были рождены в Научном центре акушерства, гинекологии и перинатологии имени академика В.И. Кулакова в период с 14 января 2014 г. по 23 февраля 2015 г. Из 243 новорожденных 211 (87%) были доношенными (37– 41 (38,4+0,9) нед), 32 (13%) – недоношенными (32– 36 (35,2+1,1) нед). Распределение по полу было следующим: 117 (48%) девочек и 126 (52%) мальчиков. Дети родились с оценкой по шкале Апгар от 4 до 9 (7,2+1,8) баллов на 1-й минуте жизни и от 5 до 9 (8,3+2,0) баллов на 5-й минуте жизни, 16% (n=37) детей испытывали асфиксию средней степени тяжести при рождении, тяжелую асфиксию перенесли 0,8% (n=2) новорожденных.
На основании данных пренатальной диагностики сразу после рождения детей переводили в отделение хирургии, реанимации и интенсивной терапии новорожденных для углубленного обследования, и хирургического лечения.
Наиболее часто поступали в отделение дети с пороками развития почек (24%), на втором месте по частоте – порок развития передней брюшной стенки – гастрошизис (15%), на третьем месте – пороки развития легких и киста яичника (по 11%). Остальные врожденные пороки встречались реже. Более 80% (n=197) детей требовалась хирургическая коррекция врожденных пороков развития, из них 36% (n=71) были оперированы в первые 4–8 ч от момента рождения, 22% (n=43) – к концу 1-х суток жизни. Остальные дети были оперированы в период с 2-х до 18-х суток жизни.
В связи с поставленной целью выявления факторов риска перинатального поражения ЦНС в дооперационном, интраоперационном и послеоперационном периодах всем детям оценивался неврологический статус, проводилось скрининговое нейросонографическое исследование (трехкратно) и нейрофизиологические методы исследования (ЭЭГ, амплитуд-интегрированная ЭЭГ – аЭЭГ). В соответствии с внутренним протоколом отделения нейросонографию осуществляли в первые часы после рождения (4,9±1,7 ч), перед оперативным вмешательством, через 24–48 ч после оперативного вмешательства и далее не реже 1 раза в неделю. Исследование проводили врачи отделения ультразвуковой (УЗ) диагностики в неонатологии и педиатрии на УЗ-аппарате экспертного класса SIEMENS Acuson S2000.
Неврологический осмотр обследуемых больных проводился согласно стандартизованным методикам с учетом гестационного возраста ребенка (Бондаренко Е.С., Журба Л.Т., Мастюкова Е.А., Dubwits L.M.S., Prechtl H.F.R., Шабалов Н.П., Пальчик А.Б.) до операции и в послеоперационном периоде после отмены обезболивающих средств. Неврологический статус оценен у 16% больных в дооперационном периоде и у 54% – после хирургического лечения. Мониторинг церебральной функции (аЭЭГ) выполнен 15 (6,2%) детям в непрерывном режиме в течение 24 ч аппаратом Natus Olimpic Brainz Monitor. У 8 (3,3%) детей были обнаружены изменения паттерна аЭЭГ – проведена стандартная ЭЭГ аппаратом Энцефалан-ЭЭГ 19/26 Медиком МТД.
МРТ-исследование было проведено у 15 (6,2%) из 243 новорожденных c врожденными пороками внутренних органов. В том числе 4 ребенка страдали врожденной диафрагмальной грыжей, по 2 ребенка – гастрошизисом, гидронефрозом, стенозом двенадцатиперстной кишки, множественными врожденными пороками развития, по 1 ребенку – аденоматозом легкого, бронхогенной кистой, омфалоцеле. Исследование осуществляли на аппарате Siemens Magnetom Verio с индукцией магнитного поля 3 Tл, оснащенном специализированной педиатрической катушкой для обследования головного мозга, системой контроля жизненно важных функций (SpO2, ЧCC) и МР-совместимым аппаратом искусственной вентиляции легких. МРТ головного мозга проводилась в режимах: T1, T2, DWI, FLAIR, SWI, времяпролетной магнитно-резонансной ангиографии (МР-АГ), в том числе у 2 детей в режиме контрастной МР-АГ.
Результаты
По результатам комплексного неврологического и клинико-инструментального обследования детей с врожденными пороками внутренних органов более 42% (n=102) имели признаки поражения ЦНС. Основными проявлениями перинатального поражения ЦНС были: синдром угнетения – у 34 (33%), изменение мышечного тонуса и двигательные нарушения – у 59 (58%), судорожный синдром – у 6 (6%), что и соответствовало результатам, полученным при использовании методов нейровизуализации, аЭЭГ и ЭЭГ. Получилось, что в раннем и позднем постоперационном периодах, а также перед выпиской синдром двигательных нарушений регистрировался у 8–10 (8–9%) детей. Синдром мышечной дистонии устанавливался неврологом чаще всего перед выпиской и наблюдался у 38 детей. Гипертензионно-гидроцефальный синдром был выявлен в постоперационном периоде у 3 детей с врожденной диафрагмальной грыжей и потребовал вентрикулоперитонеального шунтирования. Судорожный синдром до операции на блюдался у 1 (1%) ребенка, после операции – у 6 (6%) новорожденных с трансформацией в диагноз эпилепсии у 2 (2%) детей.
Наиболее тяжелые неврологические проявления гипоксически-ишемической энцефалопатии имели дети с врожденной диафрагмальной грыжей. Энцефалопатия у этих детей сочеталась с высокой легочной гипертензией, повышенным давлением в системе верхней полой вены, что влияло на церебральную гемодинамику и ее ауторегуляцию.
Хирургическая коррекция таких врожденных пороков, как гастрошизис и омфалоцеле, приводит к повышению внутрибрюшного давления и сказывается на гемодинамике в системе нижней полой вены и аорты, а также влияет на почечный кровоток.
У 50% детей с признаками поражения ЦНС, по данным нейросонографии, были выявлены различные структурные изменения головного мозга. Из них наиболее часто встречалось расширение наружных и внутренних ликворных пространств, внутрижелудочные кровоизлияния различной степени тяжести.
МРТ головного проводилась 15 из 53 детей с выявленными при нейросонографии структурными поражениями ЦНС. По данным МРТ, внутрижелудочковые кровоизлияния обнаружены у 8 (3,3%) из 243 пациентов с пороками развития внутренних органов, подоболочечные (субдуральные и субарахноидальные) кровоизлияния – у 3 (1,2%), церебральные кисты – у 1 (0,4%), паренхиматозные кровоизлияния – у 2 (0,8%). Тромбоз церебральных синусов методом МРТ был выявлен у 3 (1,2%) детей, у 1 (0,4%) ребенка имелись косвенные признаки этого нарушения по данным нейросонографии. Расширение наружных и внутренних ликворных пространств в сочетании с внутрижелудочковыми кровоизлияниями различной степени тяжести, расширением субдурального пространства наблюдалось чаще в группе детей с врожденной диафрагмальной грыжей – у 15 (20%). Замедленный кровоток и перегрузка системы верхней полой вены у 3 детей осложнились внутричерепной гипертензией, внутрижелудочковыми кровоизлияниями различной степени тяжести, церебральным синус-тромбозом, структурным повреждениям головного мозга с клиническими проявлениями гипоксически-ишемической энцефалопатии, определяя в дальнейшем неврологический исход. Острое нарушение мозгового кровообращения по ишемическому типу в бассейне правой задней мозговой артерии с поражением правой таламической области было выявлено у 1 ребенка с врожденной диафрагмальной грыжей в сочетании с коарктацией аорты (подтверждено по данным и нейросонографии, и МРТ).
Выводы В результате комплексного неврологического и клинико-инструментального обследования детей с врожденными пороками внутренних органов более чем у 40% установлены клинические признаки поражения ЦНС, которые в большинстве случаев – у 55 (54%) детей имели транзиторный характер, а у 22 (22%) – и органическую природу и сочетались со структурными изменениями головного мозга. Наиболее серьезные неврологические нарушения отмечались у детей с врожденной диафрагмальной грыжей, гастрошизисом, омфалоцеле, множественными врожденными пороками, тяжелыми пороками развития легких в связи с развивающимися гемодинамическими расстройствами, влияющими на мозговой кровоток.
Для полноценной оценки факторов риска дети с врожденными пороками нуждаются в амбулаторном катамнестическом наблюдении с оценкой психомоторного развития. Нейросонография и МРТ являются взаимодополняющими методами диагностики врожденных и перинатальных поражений головного мозга.
Материал подготовила врач ультразвуковой диагностики
Литвинова Г.В.Изучение наследственных нарушений слуха и появление новых технологий в молекулярной генетике совершили настоящий переворот в клинической аудиологии, открыв новый раздел – функциональную генетику слуха. Генетические нарушения слуха подразделяются на синдромальные и несиндромальные формы. При синдромальных формах потеря слуха сочетается с патологией других органов, разнообразными аномалиями, пороками развития и т.д. Эти формы составляют 30% от всей диагностируемой тугоухости, 70% приходится на несиндромальные формы.
Одной из форм синдромальной тугоухости является синдром Ушера: генетическое заболевание, характеризующееся потерей слуха и прогрессирующей потерей зрения. Генетическая природа синдрома установлена С.Ушером в 1914 году. Синдром наследуется по аутосомно-рецессивному типу, а причиной в 53,2% случаев является мутация в гене MYO7A1, ген локализован в хромосоме 11q. Частота встречаемости синдрома составляет 3-6 случаев на 100 тысяч населения, а распространенной у детей с глубокой тугоухостью и глухотой составляет 10%.
Выделяют 4 типа синдрома Ушера:
1 тип (около 90% наблюдений): врожденная глубокая сенсоневральная тугоухость или глухота, пигментный ретинит с прогрессирующим снижением зрения (диагностируется к 10 годам);
2 тип (около 10% наблюдений): тяжелая врожденная сенсоневральная тугоухость, пигментный ретинит с прогрессирующим снижением зрения (диагностируется к 10-20 годам), вестибулярные реакции понижены или не нарушены;
3 и 4 тип (менее 1% наблюдений): потеря слуха, прогрессирующая до глухоты, а также пигментный ретинит, прогрессирующий в пубертатном периоде, а вестибулярные нарушения выявляются в половине случает; 4 тип схож со 2, но выявляется чаще у лиц мужского пола.
Таким образом, для определения правильного подхода к педагогической коррекции таких детей необходимо как можно раньше точно диагностировать все имеющиеся у ребенка дефекты, определить характер и прогноз нарушенных функций, а также провести адекватную медицинскую реабилитацию.
Подготовила врач сурдолог-оториноларинголог Холина Ю.А.
(по материалам статьи)
Материал подготовлен на основании статьи: Е.А.Филиппова1, М.И.Пыков2, В.Э.Рычкова*2, А.В.Дегтярева1, А.А.Пучкова1 1ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И.Кулакова» Минздрава России. 117997, Россия, Москва, ул. Академика Опарина, д. 4; 2ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России. 125993, Россия, Москва, ул. Баррикадная, д. 2/1
Введение
Синдром холестаза у новорожденных и детей первых месяцев жизни является одним из ранних признаков широкого спектра заболеваний гепатобилиарной системы. В генезе заболеваний лежит несостоятельность внутри- и внепеченочных структур гепатобилиарной системы, являющихся неотъемлемым звеном сложной системы образования и экскреции желчи. Эти дефекты могут быть генетически наследованными или возникать под воздействием экзогенных факторов. Эффективность лечения данных заболеваний печени зависит от сроков их начала, в связи, с чем особую значимость приобретает проблема ранней диагностики.
Значительное разнообразие и волнообразное течение клинических и лабораторных изменений при синдроме холестаза не позволяют выявить диагностически значимые признаки. Трудности дифференциальной диагностики возникают из-за сходства, а иногда и общей клинической картины, лабораторных показателей различных форм внутри- и внепеченочного холестаза. Вместе с тем ни один из инструментальных методов не имеет 100% специфичности. Часто под маской атрезии внепеченочных желчевыводящих путей протекают заболевания печени, проявляющиеся внутрипеченочным холестазом. Так как заболевание, проявляющиеся внепеченочным холестазом, очень часто требует раннего хирургического вмешательства, необходима своевременная диагностика, включающая сочетанную оценку клинико-лабораторных и инструментальных данных, а также исключение других заболеваний гепатобилиарной системы . Ранняя дифференциальная диагностика играет важную роль в определении оптимальной тактики ведения детей, связанной с необходимостью хирургического вмешательства и своевременного начала этиопатогенетической терапии, направленной на профилактику и лечение осложнений длительно сохраняющегося синдрома холестаза и формирующегося цирроза печени. Одной из наиболее тяжелых форм неонатального холестаза, трудно поддающихся лечению заболеваний печени у детей первых месяцев жизни и требующих раннего хирургического вмешательства, а именно проведения операции по Касаи или трансплантации печени, является билиарная атрезия . Частота встречаемости 1:5 тыс. – 1:25 тыс. живых новорожденных детей. В структуре заболеваний гепатобилиарной системы в течение первых 6 мес жизни этот порок занимает ведущее место (45%). Ранние патологические изменения при билиарной атрезии наблюдаются в области ворот печени и характеризуются воспалением и фиброзом желчных протоков, что, в свою очередь, приводит к последующим необратимым изменениям в структуре печени с исходом в билиарный цирроз. В связи с этим ранняя дифференциальная диагностика билиарной атрезии является самым главным этапом, определяющим своевременное хирургическое лечение и начало этиопатогенетической терапии, направленной на профилактику и терапию осложнений длительно сохраняющегося синдрома холестаза и формирующегося цирроза печени.
Среди заболеваний, проявляющихся внутрипеченочным холестазом и часто протекающих под маской билиарной атрезии, диагностическое значение имеет синдром Алажиля (СА). Он также известен как синдром Алажиля–Уотсона, или артериопеченочная дисплазия. Это генетическое заболевание с аутосомно-доминантным путем передачи, включает в себя аномалии развития желчевыводящих путей в виде врожденной гипоплазии внутрипеченочных желчных протоков, проявляющейся неонатальным холестазом; аномалиями развития сосудов и сердца, а именно ветвей легочной артерии, изменениями со стороны скелета, глаз, почек, и имеет характерный лицевой дисморфизм. Распространенность отмечается с частотой 1:70тыс. живых новорожденных детей.
Диагностика СА основывается на данных биопсии печени, генетическом анализе и не менее трех из пяти основных признаков: хронический холестаз, сердечно-сосудистая патология, аномалии позвоночника, особенности строения глаз и лицевого отдела черепа. Изменения гепатобилиарной системы при СА, обусловленные недостаточным количеством внутрипеченочных желчных протоков, занимают ведущее место и в 70% случаях характеризуются тяжелым течением с формированием патологических состояний, нарушающих качество жизни больного и являющихся показанием к трансплантации печени. Однако высокая вариабельность клинических проявлений синдрома затрудняет постановку диагноза и как следствие – откладывает поддерживающую терапию на неопределенный срок. Учитывая, что своевременно начатое симптоматическое лечение способствует стабилизации процессов в печени и улучшению состояния ребенка, оперативное вмешательство по Касаи не приводит к необходимому терапевтического эффекту, а в ряде случаев усугубляет клиническую картину, мы поставили перед собой цель изучить и сравнить ультразвуковую картину органов гепатобилиарной системы у детей с СА и билиарной атрезией в течение первых 3 мес жизни.
Цель – определить закономерности развития эхографических изменений органов брюшной полости у детей с билиарной атрезией и СА в течение первых 3 мес жизни.
Материалы и методы В отделении ультразвуковой диагностики научноконсультативного диагностического центра на базе ФГБУ «НМИЦАГиП им. акад. В.И.Кулакова» был проведен ретроспективный анализ результатов ультразвуковых исследований органов гепатобилиарной системы 48 детей (21 мальчик и 27 девочек) с СА и 80 детей (37 мальчиков и 43 девочки) с билиарной атрезией в возрасте 1, 2 и 3 мес жизни. У всех пациентов клинико-лабораторные признаки синдрома холестаза появились в течение 1-го месяца жизни. У детей с БА отмечались желтуха с зеленоватым оттенком, обесцвеченный стул, увеличение размеров печени и у большинства – увеличение селезенки ниже реберной дуги при пальпации. У детей с СА также отмечалась желтуха, гипо- или ахоличный стул, при этом увеличение размеров печени и селезенки пальпаторно выявлялось менее чем в 1/2 случаев. При обследовании у всех детей наблюдалось увеличение биохимических маркеров холестаза: билирубина за счет прямой фракции, холестерина, g-глутамилтрансферазы, щелочной фосфатазы и ферментов цитолиза (аланинаминотрансферазы, аспартатаминотрансферазы). Показатели, отражающие синтетическую функцию печени в период наблюдения, оставались в пределах нормы.
Ультразвуковое исследование органов гепатобилиарной системы проводилось по общепринятой методике на сканерах экспертного класса GE Voluson E8, Toshiba Aplio XP конвексными и линейными датчиками с частотой 3,5–5,0 и 10–14 МГц. Эхографическая оценка осуществлялась с использованием В-режима, цветового допплеровского картирования и импульсноволновой допплерометрии. В В-режиме оценивались: печень – расположение, форма, край, эхогенность и однородность паренхимы, переднезадние размеры (толщина) правой и левой долей, толщина (переднезадний размер) сегмента хвостатой доли от толщины всей печени в любых плоскостях сканирования (индекс первого сегмента не более 30%), внутрипеченочные желчные протоки, сосудистый рисунок, диаметры и наличие просвета сосудов, содержимое ворот печени; желчный пузырь – расположение, форма, размеры, толщина стенки и внутренний контур, содержимое желчного пузыря натощак, видимые фрагменты общего желчного протока; селезенка – расположение, размеры, эхогенность и однородность паренхимы, сосудистый рисунок и сосудистая ножка. В режиме цветового допплеровского картирования оценивалось направление кровотока в ветвях воротной вены, печеночных, верхней брыжеечной и селезеночной венах. При импульсно-волновой допплерографии оценивались фазность, направление и скорость кровотока в стволе воротной вены, селезеночной и верхней брыжеечной венах, скорость и индекс резистентности на уровне сегментарных и долевых ветвей печеночной артерии, а именно возле левой долевой ветви.
Цель – на основании динамического ультразвукового исследования установить изменения органов брюшной полости у детей с билиарной атрезией и СА.
Результаты и их обсуждение В результате проведенного исследования выявлены следующие изменения исследованных органов у детей с диагностированным СА и билиарной атрезией в первые 3 мес жизни. изменения печени.
Изменения печени
При билиарной атрезии в 1-й месяц жизни отмечалось увеличение размеров печени за счет правой доли у 65 (81,2%) детей в среднем до 73±9 мм, во 2 и 3-м месяцах у всех 80 (100%) обследованных, в среднем до 80,5±9,5 и 85,5±7,5 мм соответственно. Размеры печени у детей в возрасте 1 мес жизни были достоверно меньше, чем у больных старше 2 мес.
При СА данный признак отсутствовал у детей в первые 2 мес жизни, появляясь в возрасте 3 мес лишь у 6 (12,5%) детей. Неоднородность паренхимы в виде участков повышенной эхогенности и гиперэхогенных включений в 1-й месяц не встречалась ни у одного ребенка, и только к началу 3-го месяца жизни определялась у 11 (13,5%) детей с билиарной атрезией и 4 (8,3%) больных с СА.
Бугристость контуров печени при билиарной атрезии в 1 мес жизни достоверно не определялась. В 2 мес данный признак выявлялся у 3 (3,75%), а к 3-месячному возрасту определялся у 13 (16,25%) детей.
При оценке контуров и краев печени при билиарной атрезии закругление краев печени в 1 мес не отмечалось, в 2 мес выявлялось у 6 (7,5%) детей и 21 (26,25%) ребенка в 3 мес жизни. Тогда как при СА лишь у 2 (4,2%) детей определялось закругление краев печени.
Перипортальный фиброз в 1 мес жизни в виде диффузного повышения эхогенности по ходу ствола и ветвей воротной вены отмечался при билиарной атрезии у 6 (7,5%) пациентов, в 2 мес – 36 (45%), а в 3 мес жизни достоверно выявлялся у всех 80 (100%) детей (p
зацией уменьшенных размеров, неравномерным утолщением стенок и эхогенной желчью в просвете.
Допплерографические показатели внутрипеченочной гемодинамики у всех детей были в пределах возрастной нормы. Гемодинамических признаков портальной гипертензии (снижение скорости кровотока в воротной вене меньше 14 см/с, инверсия потока крови в воротной вене, реканализация пупочной вены и расширенные вены пищевода) у детей первых 3 мес жизни замечено не было. Единственным интересным, но редко встречающимся и увеличивающимся с возрастом симптомом оказался повышенный индекс резистентности до 0,80–0,86 в ветвях печеночных артерий. Он встречался у 14 (17,5%) детей с билиарной атрезией и лишь у 1 (2,1%) ребенка с СА. Венозный отток у всех детей был псевдопортальный, но до 4 мес жизни у таких пациентов данный признак можно считать нормальным.
Изменения желчного пузыря и желчных протоков
В 1-й месяц при первичном исследовании у пациентов с билиарной атрезией желчный пузырь натощак достоверно не определялся в типичном месте у 26 (32,5%) детей и определялся в виде фиброзного тяжа у 45 (56,25%) больных. У 9 (11,25%) детей визуализирован измененный желчный пузырь минимальных размеров (длиной до 15 мм) с утолщенными стенками и минимальным просветом. На протяжении 3 мес размеры и структура желчного пузыря у детей с билиарной атрезией не менялись. При СА в 13 (27,1%) случаях при первичном исследовании натощак в 1 мес жизни желчный пузырь не определялся или был в форме тяжа с последующей визуализацией уменьшенных размеров, неравномерным утолщением стенок и эхогенной желчью в просвете. Признаки гипоплазии отмечались у 15 (31,3%) детей (желчный пузырь, максимальная длина которого не превышала 19 мм). У 20 (41,7%) детей желчный пузырь достоверно выявлялся нормальных размеров, неправильной формы с признаками деформации за счет перегибов и перетяжек.
Расширение внутрипеченочных желчных протоков и общего желчного протока при билиарной атрезии в первые 2 мес жизни не выявлялось, но к концу 3-го месяца определялось у 3 (3,75%) детей. При СА данный признак отсутствовал в 1 и 3 мес.
Изменения селезенки
При ультразвуковом исследовании селезенки в 1 мес жизни у детей с билиарной атрезией достоверно определялось умеренное увеличение размеров (на 2–3 см больше возрастной нормы, составляло приблизительно 70±5 мм) у 40 (50%) детей, тогда как при СА наблюдалось только у 5 (10,4%).В 2 мес спленомегалия фиксировалась у 63 (78,75%) детей с билиарной атрезией и прогрессировала к 3-месячному возрасту у всех обследованных . Тогда как при СА увеличение размеров селезенки отмечалось в 2 мес у 7 (14,6%) и к 3 мес – у 12 (25%) детей. Увеличение размеров было незначительным, превышающим возрастную норму на 1,5 см и составляло приблизительно 55±5 мм.
Обсуждение В нашем наблюдении у большинства детей с билиарной атрезией в возрасте 1 мес жизни и у всех пациентов в 2 и 3 мес отмечалось увеличение размеров печени, тогда как при СА они оставались в пределах нормы в течение всего периода наблюдения у большинства обследованных. Подобные закономерности наблюдались при оценке эхогенности паренхимы печени, повышение которой достоверно чаще выявлялось у детей с билиарной атрезией. Кроме того, отмечалось нарастание размеров печени и повышения эхогенности в динамике в течение первых 3 мес жизни, что, вероятно, служит отражением патологических изменений печени при билиарной атрезии. Внутриутробно образуется очень небольшое количество желчи, а отсутствие проходимости желчных протоков частично компенсируется материнским организмом, в связи с чем при рождении отмечаются минимальные изменения в печени или они могут полностью отсутствовать. В типичных случаях в раннем неонатальном периоде у детей с билиарной атрезией печень не увеличена, при проведении биохимического анализа крови может отмечаться повышение прямой фракции билирубина, тогда как другие биохимические маркеры холестаза и ферменты цитолиза остаются в пределах нормы. Степень выраженности морфологических изменений при билиарной атрезии – холестаза, пролиферации желчных протоков и фиброза была минимально выражена у детей 1 мес и значительно нарастала к 3 мес жизни с формированием в некоторых случаях начальных признаков цирроза печени. В нашем наблюдении к 3-му месяцу жизни увеличение размеров печени сочеталось с перипортальным фиброзом, бугристостью контуров, закруглением краев и ослаблением сосудистого рисунка, что также, вероятнее всего, связано с развитием фиброза и цирротических изменений печени и напрямую коррелирует с описанными в литературе морфологическими признаками. Характерной ультразвуковой особенностью у детей с билиарной атрезией явился симптом треугольного рубца, который в возрасте 3 мес жизни определялся в 1/2 случаев и отсутствовал при СА. Симптом треугольного рубца морфологически объясняется фиброзно измененными тканями в воротах печени, которые отчетливо формируются к 3 мес. По данным проведенных исследований S.Choi, W.Park, M.Kotb диагностическая точность ультразвукового метода выявления симптома треугольного рубца составляет 95%. Однако достоверность метода увеличивается до 100%, если симптом треугольного рубца определяется на фоне отсутствия визуализации желчного пузыря или изменения его формы и размеров, что также соответствует результатам отечественных. A.Tan Kendrick и соавт. предложили триаду симптомов, включающих измененный контур стенки желчного пузыря, симптом треугольного рубца, наличие диффузного перипортального фиброза, а также изменение диаметра печеночной артерии. В нашем исследовании у всех детей с билиарной атрезией отмечались изменения желчного пузыря в виде отсутствия визуализации натощак, определения в форме фиброзного тяжа, а также минимальных размеров (менее 15 мм) с утолщенными стенками и минимальным просветом, которые сочетались с перипортальным фиброзом и симптомом треугольного рубца в 50% случаев. Для СА, по данным наших наблюдений, в 1 мес жизни достоверно нехарактерно увеличение размеров печени и селезенки. При динамическом наблюдении в течение 3 мес нарастание размеров печени и селезенки было минимальное. Повышение эхогенности и неоднородность паренхимы печени за счет перипортального фиброза определялись лишь у 6 (12,5%) детей. Мы предполагаем, что описанные признаки, начинающиеся проявляться в 3-месячном возрасте, свидетельствуют о прогрессировании патологических изменений печени. По данным авторов M.Hadchouel и соавт., E.Kahn и соавт., N.Koсak и соавт., K.Emerick и соавт., для морфологического исследования биоптатов печени у детей с гипоплазией внутрипеченочных желчных протоков характерно не только уменьшение количества междольковых внутрипеченочных портальных трактов, но и раннее формирование портального и перисинусоидального фиброза, а именно от 3 до 8 мес жизни, а чаще к 6 мес жизни. Однако Y.Mizuguchi утверждает, что СА не может быть исключен морфологическими методами в раннем детстве, даже при нормальном количестве желчных протоков в биоптате; отмечая, что признаки холестаза в первый год жизни у детей с СА могут быть выраженными или уменьшаться и даже разрешаться с увеличением возраста. Желчный пузырь у большинства обследованных с СА визуализировался обычных размеров, но с разнообразной деформацией тела за счет множественных перегибов и перетяжек, у остальных детей он определялся уменьшенных размеров (менее 19 мм) или в сочетании с утолщенными слоистыми стенками и взвесью в просвете. При этом у всех детей независимо от размеров пузыря отмечалось его сокращение после приема пищи. Ультразвуковые критерии гепатобилиарной системы при СА в отечественной и зарубежной литературе в настоящее время подробно не освещены. Согласно результатам исследования P.Subramaniam и соавт. при ультразвуковом исследовании гепатобилиарной системы у детей с подозрением на СА желчный пузырь не выявлялся или определялся минимальных размеров в 27,8% случаев и впоследствии был дифференцирован как признак билиарной атрезии.
Вывод Таким образом, увеличение размеров печени, изменения структуры паренхимы, наличие перипортального фиброза и симптома треугольного рубца не являются специфическими эхографическими критериями билиарной атрезии. Только динамическое изменение этих признаков, а также сочетание с характерными особенностями строения, размеров желчного пузыря и селезенки могут иметь диагностическую ценность и помогают дифференцировать билиарную атрезию и СА.
Материал подготовила врач ультразвуковой диагностики
Литвинова Г.В.
СМА (спинальная мышечная атрофия) ― генетическое нервно-мышечное заболевание, поражающее двигательные нейроны спинного мозга и приводящее к нарастающей мышечной слабости. Заболевание носит прогрессирующий характер, слабость начинается с мышц ног и всего тела и с развитием заболевания доходит до мышц, отвечающих за глотание и дыхание. При этом интеллект больных СМА абсолютно сохранен.
В зависимости от тяжести симптомов выделяют 3 основных типа проксимальной СМА: СМА 1, СМА 2, СМА 3. Чем раньше проявляются первые признаки болезни, тем ярче выражены симптомы, тем они тяжелее и тем быстрее прогрессирует заболевание.
С 1 января 2023 года в России исследование на СМА включено в обязательный неонатальный скрининг. Тестирование новорожденных позволяет определить наличие генетической "поломки" уже в первую неделю жизни ребенка, до появления первых симптомов заболевания.
Кроме того, в московском ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» (МГНЦ) действует программа, включающая в себя в себя бесплатную транспортировку биологических образцов и бесплатное проведение молекулярно-генетического анализа наличия экзона 7 генов SMN1/SMN2 для подтверждения диагноза СМА 5q, а также бесплатное определение количества копий гена SMN2.
На сегодняшний момент на территории России зарегистрированы три лекарственных препарата для патогенетического лечения спинальной мышечной атрофии: нусинерсен (Спинраза), рисдиплам (Эврисди) и онасемноген абепарвовек (Золгенсма).
Нусинерсен — первый препарат для патогенетического лечения СМА, одобренный к применению в мире.
Рисдиплам — первый препарат с пероральным способом приема для патогенетического лечения СМА.
Онасемноген абепарвовек — первый препарат генной терапии для патогенетического лечения СМА.
На сегодняшний момент в России доступ к лекарственным препаратам осуществляется для детей за счет средств федерального бюджета через фонд «Круг добра».
Не менее важным разделом помощи пациентам со СМА является физическая реабилитация. Главная задача реабилитации человека со СМА — это профессиональное решение целого комплекса проблем. Ребенку и взрослому нужно помочь правильно сидеть, стоять или ходить и максимально сохранить те возможности, которые у него есть, а также укреплять различные группы мышц, которые в большей степени страдают при СМА.
Технические средства реабилитации (ТСР) облегчают передвижение и способность к самообслуживанию; способствуют общению и ориентации ребенка в пространстве; обеспечивают деятельность жизненно важных функций организма; облегчают уход за больными, неспособными к передвижению и самообслуживанию.
Для оценки эффективности медикаментозного лечения и реабилитации пациентам с СМА показано регулярное проведение оценки по специальным шкалам.
В нашем центре осуществляется комплексная реабилитация детей со СМА в условиях дневного и круглосуточного стационара, осуществляется подбор ТСР.
16.04.2024 прошел обучающий семинар по использованию шкал для оценки крупной и мелкой моторики у пациентов со СМА: RULM, CHOP INTEND, HFMSE, HINE, приобретено необходимое для диагностики оборудование. Специалистами уже протестированы первые пациенты, получающие реабилитацию в нашем центр.
Материал подготовлен врачом неврологом Григорьевой Е.А.
Остеохондропатии – это целая категория заболеваний опорнодвигательного аппарата, которые поражают определенные участки длинных трубчатых костей. Как правило, подвержены заболеванию те части кости, к которым прикрепляются сухожилия мышц. Остеохондропатии поражают в основном детей и подростков, у взрослых эта патология практически не встречается.
Одна из самых распространенных форм этой патологии – это болезнь Осгуда-Шлаттера, когда поражается бугристость большеберцовой кости. К этому месту прикрепляется связка надколенника. У детей и подростков все кости имеют зону роста, за счет которой конечность увеличивается в длину. Эта область располагается между эпифизами (дистальным или латеральным) и диафизом, а называется она апофиз. Именно в этом месте и находится бугристость.
Апофиз имеет отдельное кровоснабжение, и в период интенсивного роста ребенка кровеносные сосуды отстают в росте, то есть костная ткань растет быстрее. Это приводит к развитию гипоксии большеберцовой кости в области бугристости, к нехватке кислорода и питательных веществ, что делает структуру этого костного образования очень хрупкой и склонной к повреждению.
Если в этот период ребенок подвержен физическим перегрузкам, уязвимое место большеберцовой бугристости поддается постоянной микротравматизации, что вызывает специфическую защитную реакцию организма. В данной области развивается асептическое воспаление (некроз) и активизируются процессы оссификации еще не до конца сформированной бугристости. Вследствие таких нарушений наблюдается чрезмерное разрастание костной ткани в этой зоне, что внешне проявляется формированием шишки под коленом у ребенка. Процесс может быть односторонним, но чаще поражение двухстороннее.У мальчиков остеохондропатия встречается чаще, чем у девочек.
Основной пик заболеваемости наблюдается у детей 11-14 лет и встречается примерно в 13% всех детей, которые активно занимаются спортом.
В большинстве случаев заболевание протекает полностью бессимптомно и отличается доброкачественным характером, а выявляется случайно – при рентгенологическом обследовании по другому поводу. Но встречаются и клинические ситуации, когда болезнь проявляет свои симптомы и причиняет массу неудобств пациенту: боль, усиливающаяся при движении,отечность в месте бугристости, деформация
Как правило, течение болезни Осгуда-Шлаттерадоброкачественное и к моменту 21-23 лет (именно в этот период окончательно закрываются все зоны роста в костях) все патологические симптомы исчезают. У некоторых пациентов может остаться безболезненная шишка под коленом, которая никак не отражается на функции коленного сустава и нижней конечности в целом.
Чаще всего диагностика заболевания не вызывает никаких трудностей. При типичных симптомах недуга, соответственном возрасте пациента, при наличии описанных выше факторах риска патологии диагноз можно установить сразу после осмотра ребенка.
Ведущим методом диагностики болезни Осгуда-Шлаттера является рентгенография коленного сустава в боковой проекции. В норме на снимках ядра окостенения бугристостей начинают появляться в 9-12 лет в виде одной или нескольких, возможно разнокалиберных точек удлиненно-овальной формы окруженные тоненькими замыкательными пластинками, постепенно они увеличиваются и срастаются между собой, а в впоследствии и с передней поверхностью большеберцовой кости. Бывает очень сложно отличить норму от патологии, т.к. при болезни Осгуда-Шлаттера основной признак-фрагментация и смещение бугристости. Между ней и передней поверхностью большеберцовой кости ростковая зона равномерная. Признаками остеохондропатии являютсянеравномерность ростковой зоны, смещение точек окостенения, чаще кпереди, дополнительные костные фрагменты в нетипичных местах, нечеткие контуры ядер окостенения, неоднородная структура костей, затемнение нижнего выступа ромбовидного пространства.
Для правильной диагностики необходимы достаточный опыт, квалификация врача-рентгенолога, высококачественные рентгенограммы, т.к. вовремя начатое и адекватное лечение ведет излечению процесса, профилактике вторичных осложнений (бурсит, артрит, артроз), избавления от косметического дефекта (шишки), особенно у девочек.
В более тяжелых диагностических ситуациях прибегают к таким методикам обследования, как МРТ и/или КТ. Дополнительно проводят ультразвуковое исследование коленного сустава и прилегающих мягких тканей.
Подготовила врач-рентгенолог Ксензова А.Ф.
Личностная тревожность предрасполагает человека к восприятию широкого круга объективно безопасных обстоятельств как содержащих угрозу . Одним из признаков высокой личностной тревожности является избирательное усиление непроизвольного внимания к внешним потенциально опасным стимулам и снижение эффективности системы произвольного внимания , особенно в ситуациях, требующих перераспределения когнитивных ресурсов.
С другой стороны, известно, что люди с повышенной тревожностью не обязательно менее успешны, и способны повысить качество решения поведенческих задач за счет усиления произвольного контроля над вниманием, при этом они вынуждены затрачивать на выполнение заданий больше усилий, чем низкотревожные . Можно полагать, что одними из наиболее важных факторов, влияющих на эффективность когнитивной деятельности и ее физиологическое обеспечение в зависимости от уровня тревожности, являются особенности организации произвольного и непроизвольного внимания.
Согласно современным представлениям, познавательная деятельность и целенаправленное поведение обеспечиваются распределенными нейронными сетями – специфичными для конкретного вида деятельности ансамблями взаимодействующих макроскопических структур мозга . Основным механизмом формирования таких ансамблей является модуляция силы функциональных связей между их участниками . Для исследования нейронных объединений, участвующих в реализации когнитивной деятельности, может быть использован когерентный анализ ЭЭГ, позволяющий оценить функциональное взаимодействие корковых зон на коротких временных промежутках, что способствует более точной оценке мозгового обеспечения быстро изменяющихся во времени когнитивных процессов .
Впервые выявлены особенности структуры когерентных взаимосвязей тета1-диапазона ЭЭГ в состоянии относительного покоя и ее изменения при тестирования внимания, характерные для испытуемых с разной тревожностью, свидетельствующие о том, что личностная тревожность является одним из факторов, модулирующих организацию нейрокогнитивных сетей.
Наблюдавшаяся у испытуемых с высокой тревожностью в исходном состоянии при закрытых глазах меньшая, чем у испытуемых с низкой и средней тревожностью, правополушарная когерентность тета1-диапазона ЭЭГ передних областей коры может отражать характерное для этих индивидов преобладание оборонительной формы поведения, тормозящей ориентировочно-исследовательскую деятельность.
Большая межполушарная когерентность потенциалов тета1-диапазона ЭЭГ лобных, центральных и теменных областей коры, характерная для индивидов с высокой личностной тревожностью как в исходном состоянии при открытых глазах (по сравнению с испытуемыми со средней и низкой тревожностью), так и при выполнении теста (по сравнению с низкотревожными индивидами), связана с привлечением ресурсов внимания к потенциально угрожающим стимулам и усилением контроля произвольного внимания при выполнении теста.
Впервые показано, что наибольшая лабильность структуры когерентных взаимосвязей в тета1-диапазоне ЭЭГ при когнитивной деятельности характерна для испытуемых со средней личностной тревожностью, у которых наблюдалось повышение как внутри- (между лобными и центральными областями), так и межполушарной когерентности большинства областей коры при выполнении теста по сравнению с исходным состоянием.
Для индивидов с высокой тревожностью была характерна относительная инертность структуры когерентных взаимосвязей в тета1-диапазоне ЭЭГ на этапах когнитивной деятельности. Во время тестирования внимания по сравнению с предшествующим этапом у индивидов с высокой личностной тревожностью отмечалось повышение межполушарной когерентности с основным фокусом в левой теменной области, а также между центральными областями коры.
У испытуемых с низкой личностной тревожностью наблюдалось увеличение преимущественно внутриполушарной когерентности тета1-диапазона ЭЭГ большинства областей коры при выполнении теста по сравнению с исходным состоянием.
https://sciencejournals.ru/view-article/?j=jourvnd&y=2023&v=73&n=2&a=JourVND2302004Dzhebrailova
Инфомацию по материалам статьи подготовила врач функциональной диагностики Тышкевич Е.М.
Что такое сахарный диабет у детей?
Сахарный диабет, или "сахарная болезнь" — это заболевание, которое вызывает сложные нарушения углеводного, жирового и белкового обменов. Оно связано с нарушением выработки инсулина, нарушением его воздействия на органы-мишени (сетчатку глаза, артерии, почки, сердце, головной мозг) либо с сочетанием этих факторов.
Основным симптомом является гипергликемия, т. е. высокий уровень глюкозы в крови, и её проявления в виде чрезмерного употребления воды, увеличения объёма мочи и токсического воздействия на органы-мишени.
Гипогликемия как осложнение сахарного диабета 1 типа у детей
Гипогликемия (зачастую просто «гипо») — термин, используемый для обозначения состояния, при котором уровень сахара в крови слишком низкий. Это состояние может возникнуть по ряду причин. Несмотря на то, что эпизоды гипогликемии легко купировать, симптомы гипогликемии зачастую довольно неприятны, особенно для ребенка. Более того, состояние гипогликемии может быть очень опасным, поэтому важно уметь правильно распознавать симптомы и действовать максимально быстро.
Первый шаг на пути к снижению риска развития гипогликемии у ребенка — знание наиболее распространенных симптомов. В отличие от взрослых, маленькие дети неспособны вовремя распознавать симптомы приближающейся гипогликемии, поэтому очень важно, чтобы Вы регулярно проверяли уровень сахара (глюкозы) в крови ребенка в целях предотвращения выхода показателей за пределы целевого диапазона. В случае гипогликемии у ребенка у него могут наблюдаться такие симптомы:
- Слабость
- Головокружение
- Избыточная потливость
- Голод
- Головная боль
- Дезориентация в пространстве
- Размытое зрение
Поскольку степень тяжести гипогликемии может варьироваться, необходимо регулярно проверять уровень сахара в крови после потребления сахара или приема глюкозы в таблетках.
КУПИРОВАНИЕ ГИПОГЛИКЕМИИ
При наступлении гипогликемии очень важно действовать быстро, но без паники. Не усугубляйте ситуацию — ваш ребенок и без того может переживать испуг и быть не в состоянии рассказать о своих симптомах.
В зависимости от степени тяжести гипогликемии после ее купирования у ребенка может наблюдаться чувство душевной апатии — будьте готовы прийти на помощь и успокоить. К сожалению, эпизоды гипогликемии — неотъемлемая часть жизни с диабетом (а иногда, они даже встречаются у совершенно здоровых людей). Именно поэтому, дети должны с самого малого возраста уметь оказать себе необходимую помощь. Ваша задача — научить ребенка справляться с состоянием гипогликемии и сохранять спокойствие.
Важно помнить о том, что основная задача при купировании гипогликемии — вернуть уровень сахара в целевой диапазон, т. е. поднять его до нормального значения. Для этого можно:
- съесть таблетки глюкозы
- съесть конфеты (например, леденцы)
- выпить фруктовый сок
- выпить стакан сладкого напитка
- использовать набор глюкагона в случае его доступности (только для лечения тяжелых эпизодов гипогликемии)
- в случае, если ребенок потерял сознание, вызовите скорую
Через 15–20 минут после выполнения вышеперечисленных действий необходимо измерить уровень сахара в крови, чтобы убедиться, что показатели вернулись в целевой диапазон. Гипогликемия может вызывать чувство беспокойства, и, соответственно, потребуется некоторое время, чтобы прийти в себя. Дайте ребенку возможность сесть, сделать несколько глубоких вдохов-выдохов и расслабиться.
Способы лечения гипогликемии у ребенка необходимо обсудить с со своим лечащим врачом — каждый организм уникален, поэтому необходимо определить, какой метод будет наиболее эффективным в вашем случае.
НОЧНАЯ ГИПОГЛИКЕМИЯ
Контроль уровня сахара в крови — круглосуточная задача. Даже когда ребенок находится в состоянии сна, его организм работает, а уровень сахара в крови может снижаться под воздействием множества факторов, в числе которых:
- вечерний прием пищи (количество съеденных углеводов)
- интенсивность физической нагрузки
- доза инсулина перед сном
- тип инсулина
Многих родителей вышеперечисленные факторы побуждают сделать выбор в пользу приобретения системы непрерывного мониторинга глюкозы для использования в сочетании с инсулиновой помпой, например, MiniMed Paradigm Veo и, соответственно, осуществления постоянного контроля диабета у ребенка. Система НМГ исключает необходимость выполнения регулярных измерений уровня сахара в крови в ночное время — как только уровень глюкозы в крови ребенка падает, система самостоятельно уведомит об этом.
Поскольку сенсор системы НМГ выполняет мониторинг показателей в круглосуточном режиме, у Вас будет возможность получить полную информацию о том, как изменяется уровень сахара в крови ребенка в течение сна. Такие данные могут быть очень полезны при оценке эффективности лечения диабета у ребенка.
Система НМГ может использоваться в любом возрасте, начиная с 2 лет.
ПОЛНАЯ ГОТОВНОСТЬ
Наблюдение за ребенком, переживающим состояние гипогликемии, — не самая приятная картина. Тем не менее, не стоит забывать, что полностью избежать гипогликемии невозможно, а ее появление — не повод винить себя. Эпизоды гипогликемии рано или поздно переживают все больные диабетом. Вооружившись информацией о том, как распознать симптомы гипогликемии и как купировать ее, теперь только нужно запастись всем необходимым: в Вашем доме обязательно должны быть таблетки глюкозы, сладкие напитки и продукты с быстродействующими углеводами. Также позаботьтесь о том, чтобы взрослые, которые осуществляют наблюдение за ребенком, и его воспитатели/учителя, знали, когда и как лечить гипогликемию и обладали всем необходимым для этого.
Диабет у детей требует выработки особой системы поддержки для ребенка, вне зависимости от его возраста. Например, будет совсем нелишним уведомить взрослых, окружающих ребенка, об имеющемся заболевании. Осведомление воспитателей или учителей ребенка о диабете позволит им лучше понимать, как распознать симптомы приближающегося эпизода гипогликемии / гипергликемии и как купировать его.
Подготовила врач-детский эндокринолог
Ульянова Т.Н.
Гидрореабилитация – это педагогическое специфическое явление, сущность которого заключается в обучении и воспитании человека в условиях водной среды и средствами водной среды, с целью формирования качественно нового более высокого от исходного уровня физической и общественной активности человека с отклонением в состоянии здоровья (Мосунов Д.Ф., 2001).
Коррекция недостатков психического и физического развития детей с ограниченными возможностями здоровья (ОВЗ) и расстройствами аутистического спектра (РАС) – это педагогический процесс исправления или ослабления этих недостатков в целях возможно большего приближения развития таких детей к уровню развития здоровых детей.
Независимо от диагноза, все исследователи приходят к выводу о необходимости обучения ребенка, его адаптации к окружающей природной и социальное среде, а также адаптации окружающей среды к ребенку.
Последнее направление имеет ведущее значение для обучения и воспитания детей с ОВЗ и РАС в условиях водной среды, при которых вся окружающая среда непосредственно прилипает к телу, взаимодействует с ним и оказывает на него позитивное влияние.
Сегодня множество теорий объясняют, почему это происходит:
- вода стимулирует ребенка визуальными раздражителями, тем самым удовлетворяя некоторые его сенсорные потребности;
- вода предлагает «безопасную и поддерживающую среду», которая окутывает тело «гидростатическим давлением», вызывая ощущение «идеального объятия»;
- по мнению нейробиологов, освоение новых двигательных навыков, таких как плавание, способно оказывать на нервную систему человека весьма разнообразное влияние, например, увеличивать приток крови к участкам, где расположены важнейшие нейроны, способствовать перестройке аномальных структур в передней части мозга.
Мосунова М.Д., Мосунов Д.Ф. (2012) считают, что взаимоотношение человека и воды – есть единое целое физическое и общественное явление, которое формируется, развивается и проявляется пожизненно, как единое целостное специфическое явление реальной действительности, не зависящее от состояния сознания. Оно обусловлено начальной активностью взаимосвязей женских и мужских водосодержащих клеток человека. Проявляется посредством реализации в системах и органах человека магнитогидродинамического течения жидкостных сред на всех функциональных и морфологических уровнях жизненного самообеспечения.
Гидрореабилитация, обучение плаванию может привести к истинному эмоциональному прорыву у детей с аутичным поведением, проникнув под их защитный покров, соединить ребенка с окружающим миром. Стараясь удержаться на воде, ребенок становится более сосредоточенным, изменяет фокус внимания от собственного внутреннего мира на происходящее вокруг, в результате чего тревоги отходят на задний план.
Кроме того, гидрореабилитация – это комплексная тренировка всех систем организма, равномерное распределение нагрузки, низкая вероятность травматизма. Под влиянием плавания улучшается работа сердечно-сосудистой системы, опорно-двигательного аппарата, развивается капилляризация тканей, происходит закаливание организма.
Основные принципы, формы и методы гидрореабилитации детей с ОВЗ и РАС
Согласно литературным данным, основным приемом воспитания детей с ОВЗ и аутичным поведением является создание для них хорошо организованной среды и условий занятий. Необходимо так организовать занятие, чтобы избежать негативных впечатлений и наполнить его стимулами, побуждающими к определенным действиям, задающим определенную последовательность. Выполнение упражнений организуется так, чтобы дети были все время заняты, поскольку ожидание ведет к утрате интереса и переохлаждению в воде. А также:
1. Занятия должны проводиться в первую очередь с целью восстановления функций, коррекции, улучшения повседневной активности и повышения физического уровня развития детей.
2. Любые контакты и действия с детьми следует сопровождать речевыми комментариями педагога, а также активными или пассивными действиями детей; необходимо стремиться вступить в визуальный и эмоциональный контакт с детьми на уровне, соответствующем их восприятию и деятельности.
3. Вступая в общение с детьми, педагог должен осуществлять дифференцированный подход, учитывать возможности самых слабых детей в группе, строить систему упражнений в зоне их ближайшего развития.
4. Работа с методическим материалом и техническими приспособлениями должны соответствовать поставленной задаче и психофизическим возможностям детей.
5. В процессе работы должна проводиться разъяснительная работа с родителями о необходимости непрерывных и систематических занятий гидрореабилитацией.
Пригодными формами являются: занятия в малой группе в мелком бассейне под контролем педагога или индивидуальные занятия с тренером в большом бассейне.
Методика занятий по гидрореабилитации детей с ОВЗ и РАС
Эффективная методика формирования двигательной и эмоционально-волевой активности детей с ОВЗ и РАС в условиях водной среды включает:
1. Изучение исходного состояния двигательной активности детей на суше и в быту.
2. Изучение исходной возможности двигательной активности детей на воде.
3. Выявление ведущих, спонтанно выполняемых, движений детей в воде.
4. Разработку рабочей программы увеличения двигательных и волевых возможностей детей в процессе педагогической гидрореабилитации.
Основные приемы взаимодействия педагога и детей на суше и в воде:
1. Первая встреча с педагогом должна сопровождаться положительной реакцией детей. Лучше, если педагог первым проявит инициативу к знакомству, проведет по всем помещениям бассейна, объяснит назначение всех новых для детей предметов, действий и правил.
2. Необходимо говорить спокойным, четким и умеренным голосом. Некоторые дети могут быть гиперчувствительными к шуму, поэтому крик может вызывать у них болезненные ощущения или смятение.
3. У детей с РАС не происходит переноса ранее разученных навыков в новую, схожую по содержанию ситуацию, поэтому необходимо знакомить их с каждым новым предметом, обозначать словами все действия, даже если они не реагируют.
4. При обучении двигательным действиям использовать метод концентрации зрительного внимания с помощью ограничительных маркеров для понимания ребенком границ пространства, а также в концентрации его внимания в рамках этих границ.
5. Показывая правильные движения, следует вначале выполнять их вместе с детьми, но не делать этого постоянно. Движения и объяснения должны быть простыми и понятными.
6. Надо пресекать проявления неадекватного поведения, нарушения правил техники безопасности. Не давать себя кусать, бить, воздействовать словом и физически. При продолжающемся агрессивном поведении – прекращать занятие.
У детей с аутичным поведением не происходит переноса ранее разученных навыков в новую, схожую по содержанию ситуацию, поэтому выполнять имитационные упражнения на суше не имеет смысла, а необходимо сразу переходить к занятиям в воде.
На первых занятиях возможно проявление неадекватного поведения, связанного с водобоязнью. Наиболее яркими проявлениями страха перед водой могут быть крик, укусы запястий рук или удары педагога.
Агрессивные действия детей с РАС можно расценивать по-разному. Например, как страх перед водой или нежелание плавать; или как одну из форм контакта с окружающим миром, как желание привлечь внимание, самоутвердиться и даже выразить собственный восторг и благодарность, либо данным образом снизить внутренне беспокойство.
Большое внимание следует уделять методике проведения занятия. Нужно подробно распланировать весь ход урока: порядок перехода от одного вида упражнения к другому, какими эмоциональными и игровыми моментами заинтересовать ребенка и т. д.
Постепенно на занятиях у детей следует развивать внимание к командам, к показу упражнений, к слуховым и зрительным сигналам.
Эффективность работы в воде с детьми, имеющими черты аутичного поведения, во многом зависит от возможности и умения педагога предупреждать и преодолевать опасные ситуации, создающие угрозу жизни и здоровью.
Материал подготовлен инструктором-методистом по лечебной физкультуре Бредихиным Н.С.
Учитывая появление в медицинcкой лучевой диагностике цифровых малодозовых рентгеновских аппаратов, потенциал их использования в изучени патологии у детей любого возраста значительно расширился. Доза облучения пациента при проведении рентгенографии на рентгенаппарате в ГУЗ ТО «Центр детской психоневрологии» в 10 раз меньше, чем у других обычных аппаратов. Информативность и качество цифровых рентгенограмм намного выше, возможность их постобработки (регулирование яркости, контрастности, увеличения изображения, позитив-негатив, многократное копирование снимков без повторного облучения больного, различные варианты распечатывания снимков: на пленке, термобумаге, флэшке, диске) еще больше снижают дозу облучение пациентов. Для этой же цели мы всегда используем защитные средства (воротники, фартуки, передники, юбки) для детей и сопровождающих их родителей, диафрагмируем, то есть адекватно уменьшаем поле облучения снимаемого объекта.
В связи с этим, в нашей больнице мы стали чаще исследовать органы и системы кроме стандартных, еще и в специальных укладках. Нередко обследуется весь позвоночник за одно посещение с целью составления заключения о нем, как о едином целом с указанием локализаций всех аномалий развития, сколиотических дуг и противодуг, их взаимосвязи, функционального поведения при пробах и т.д.
При исследовании шейного отдела позвоночника (ШОП) мы всем детям проводим не только стандартную ренгенографию в 2-х проекциях (прямая и боковая) для визуализации анатомии ШОП, при этом мы видим с 3-го по 7-й шейный позвонок, но и трансоральные снимки (через открытый рот) для диагностики 1-го и 2-го шейных позвонков, ширину рентгенщелей между ними, выявление незаращения дужек и тел позвонков, строение и отклонения зубовидного отростка 2-го шейного позвонка, других аномалий краниовертебрального перехода в прямой проекции, также производятся функциональные пробы (снимки при максимальных сгибании и разгибании шеи в боковой проекции, реже наклоны вправо-влево в прямой проекции). При этом кроме уточнения анатомии шейного отдела, мы диагностируем его функцию, т.е. «поведение» позвонков, их смещаемость кпереди-кзади относительно друг друга (нестабильность, листез), амплитуду смещений в миллиметрах, стабильность или нестабильность смещений во всех сегментах или в единичных. Пробы позволяют уточнять наличие таких аномалий развития, как ассимиляция атланта, конкресценции (сращения) позвонков, отростков, наличия хондроза (стойкого снижение высоты межпозвонковых дисков) и др.
Реже мы проводим функциональные пробы грудного (ГОП) и поясничного (ПОП) отделов, чаще для установления стабильности или нестабильности смещения (листеза) позвонков, степени и амплитуды соскальзывания позвонков кпереди и кзади. При необходимости проводим рентгенографию позвоночника стоя и лежа для выявления разницы углов при сколиозе, для дифференциальной диагностики нарушения осанки по сколиотическома типу и истинного сколиоза с торсией (разворотом) позвонков, в боковой проекции для выявления статического (стоя) и истинного кифоза.
При исследовании тазобедренных суставов наряду со стандартной рентгенографией при незначительной внутренней ротацией бедер мы нередко проводим специальные укладки. По Лаунштейну (с разведением бедер в «позе лягушки») мы уточняем форму, структуру, симметричность головок бедер, вправляемость их в полость суставов при нестабильности, подвывихах и вывихах. При внутренней ротации бедер с разведением их в стороны мы измеряем истинный шеечно-диафизарный угол, форму, размеры, симметрию шеек бедер, так же определяем вправляемость их в полость суставов при нестабильности, подвывихах и вывихах.
Нередко по показаниям мы проводим дополнительные специальные исследования и укладки при диагностике болезней в ЛОР-патологии, органов грудной клетки, черепа, других суставов и костей, ЖКТ.
Все это ускоряет диагностику болезней, дает много дополнительной и важной информации для дальнейшего адекватного лечения и образа жизни пациентов.
Материал подготовила врач-рентгенолог Ксензова А.Ф.
Плоскостопие – это самое широко распространенное заболевание стопы. Оно встречается как в молодом возрасте, так и в старшем. Причем у женщин встречается несколько чаще, чем у мужчин. В норме стопа имеет продольные и поперечные своды. Свод – это естественный ее изгиб, необходимый для стабилизации тела человека и амортизации при движении. Своеобразные дуги образованы пяточной костью и костями предплюсны и плюсны (находятся в основании пальцев). При нарушении величины даже одной из этих дуг, меняется форма всей стопы. Это происходит при потере баланса между нагрузкой и возможностями мышечно-связочного аппарата нижней части конечностей. Это важная ортопедическая проблема, при которой страдает не только состояние опорно-двигательной системы, но и общее состояние человека; снижается выносливость к физическим нагрузкам, работоспособность, повышается утомляемость и раздражительность, так как симптомы распространяются гораздо выше уровня стопы.
Существует множество классификаций данной патологии. Каждая из них выделяет проблему по одной из характеристик.
По типу:
- Поперечное. В этом случае передний отдел стопы опирается сразу на 5 плюсневых костей. Наиболее часто встречается у людей в возрасте от 35 до 50 лет. Особенно распространено среди женщин, в том числе из-за высоких каблуков.
- Продольное. В группе риска возрастная группа от 16 до 25 лет. Стопа соприкасается с поверхностью опоры практически всей своей площадью. Данный вид, его степень прямо пропорционален весу человека.
Возможно их сочетание.
По причинам:
- Врождённое. Встречается нечасто. Характерно для людей с врожденной дисплазией соединительной ткани.
- Рахитическое. Рахит развивается при недостатке поступления кальция в организм и нарушении его усваивания в детстве, когда происходят основные этапы формирования опорно-двигательного аппарата.
- Травматическое. Формируется при травмах в данной локализации.
- Паралитическое. Как правило, является последствием полиомиелита, детского церебрального паралича.
- Статическое. Возникает при длительном пребывании стоя на ногах, при избыточной массе тела.
- Динамическое. При тяжелых нагрузках и различных видах спорта, долгой ходьбе, особенно в неудобной обуви
По степени:
- Стопа при первой степени сохраняет своды, но они становятся слегка уплощенными. Связочно-мышечный аппарат ослабляется. Походка менее пластична. После длительной ходьбы возникает усталость, отечность, боли.
- Вторая степень плоскостопия демонстрирует уплощенную стопу, ее форма расширена. Обувь становится неудобной. Появляется изменение походки, отеки. Болевые ощущения характерны для всего голеностопного сустава.
- На третьей изменение стопы выражено, деформируются пальцы, артрозы суставов. При отсутствии лечения, болевой синдром приобретает постоянный характер, распространяются и на голень, бедро и поясничную область. Нередки головные боли. Трудоспособность пациента снижается. Ходьба в обычной обуви приносит мучительные боли.
В механизме поперечного плоскостопия определенную роль играет слабость подошвенного апоневроза. В норме передний отдел стопы опирается на головки I и V плюсневых костей. При плоскостопии головки II–IV плюсневых костей опускаются, становятся в один ряд, промежутки между ними увеличиваются, плюснефаланговые суставы находятся в положении разгибания, со временем формируются подвывихи основных фаланг. Характерно переразгибание в плюснефаланговых суставах и сгибание в межфаланговых суставах. Расширяется передний отдел стопы, при этом имеют место следующие варианты: • чрезмерное отклонение I плюсневой кости кнутри, а 1-го пальца кнаружи – halluх valgus; • избыточное отклонение I плюсневой кости кнаружи; • веерообразное расхождение плюсневых костей; • молоткообразные пальцы. При III степени плоскостопия стопа принимает вальгусное положение, пятка распластана и вальгирована, стопа и голеностопный сустав отечны, суставы стопы тугоподвижны, развиваются контрактура пальцев (молоткообразные пальцы), деформирующий артроз в суставах предплюсны, затрудняется ходьба, снижается трудоспособность, ношение обуви массового производства невозможно. Диагноз плоскостопия ставят на основании осмотра, плантографии, подографии и данных рентгенографии.
Достоверными критериями степени поперечного плоскостопия являются угол отклонения I плюсневой кости (угол между осями 1-й и 2-й плюсневых костей )и угол между осями плюсневой кости и основной фаланги 1-го пальца. На рентгенограммах проводят прямые линии, соответствующие продольным осям I–II плюсневой кости и основной фаланге 1-го пальца.
Существуют 4 степени такой деформации стопы:
I степень - угол между I–II плюсневыми костями 10 -12 град., угол отклонения 1-го пальца 15 -20 град.
II степень - между I–II плюсневыми костями 12-15 град., угол отклонения 1-го пальца 20-30 град.
III степень - между I–II плюсневыми костями 15-20 град,, угол отклонения 1-го пальца 30-40 град.
IV степень - угол между I–II плюсневыми костями более 20 град., угол отклонения 1-го пальца более 40 град.
Одним из важных вопросов является правильная диагностика вида и степени плоскостопия для юношей и девушек призывного возраста или поступающих в военные учебные заведения. Эта диагностика так же необходима для выбора адекватного лечения этой патологии с целью предотвращения появления таких осложнений, как постоянные боли в ногах, пояснице, нарушения осанки, появление и усиление степени сколиоза, изменение походки, косолапие и деформация голени при развитии плоскостопия в детском возрасте, возникновение деформации пальцев стопы, появление halluх valgus, артрозов в различных суставах нижних конечностей, формирование межпозвонковых грыж, врастание ногтей и т.д.
Подготовила врач-рентгенолог Ксензова А.Ф.
Плоскостопие - деформация стопы, как врожденная так и приобретенная, характеризуется уплощением продольного и поперечного сводов стопы в сочетании с поворотом кнутри вокруг продольной оси, а также ее отведением.
Среди всех деформаций стоп, с жалобами на боли в этой области и без жалоб статические деформации составляют чрезвычайно большой процент - 61,3%. Поперечное плоскостопие в сочетании с другими деформациями составляет примерно 55%, продольное плоскостопие - около 30%. Данная патология наблюдается в равной степени как у лиц сидячих профессий, так и у выполняющих работу стоя, однако лица, работа которых связана с длительным стоянием, жалуются на боли в стопах в 2 раза чаще, чем лица сидячих профессий.
По происхождению плоскостопия различают врожденную плоскую стопу, травматическую, паралитическую и статическую.
Врожденное плоскостопие установить раньше 5-6 летнего возраста нелегко.
Травматическое плоскостопие формируется вследствие перелома лодыжек, пяточной кости, предплюсневых костей.
Рахитическое плоскостопие обусловлено нагрузкой тела на ослабленные кости стопы.
Статическое плоскостопие возникает вследствие слабости мышц голени и стопы, связочного аппарата и костей.
К внутренним причинам относятся наследственно-конституционное предрасположения, к внешним причинам - перегрузка стоп.
Кости стопы делятся на три отдела: проксимальный - кости предплюсны, средний - плюсна, дистальный - кости пальцев стопы. Кости стопы располагаются по отношению к костям голени под прямым углом и соединяются с ними посредством голеностопного сустава.
Стопа человека, являясь опорным отделом нижней конечности, в процессе эволюции приобрела форму, позволяющую равномерно распределять нагрузку. Это осуществляется благодаря тому, что кости предплюсны и плюсны соединены между собой прочными межкостными связками и образуют свод, обращенный выпуклостью к тылу и обусловливающий рессорную функцию стопы. Выпуклые своды стопы ориентированы в продольном и поперечном направлении. Поэтому стопа опирается не всей поверхностью, а на три точки.
Плоскостопие находится в прямой зависимости от массы тела: чем больше масса и, следовательно, нагрузка на стопы, тем более выражено продольное плоскостопие. Данная патология имеет место в основном у женщин. Достоверная диагностика продольного плоскостопия возможна чаще всего в возрасте 16-25 лет, когда апофизы костей срастаются с метафизами посредством заращения эпиметафизарных ростковых зон. Определение степени плоскостопия основывается на данных рентгенографии и подометрии.
Рентгенологическое исследование ставит своей целью:
- выявить степень плоскостопия;
- выявить стадию развития деформирующего артроза.
Основным и частым методом обследования на продольное плоскостопие является рентгенография стоп с нагрузкой.
Производят снимки стоя на специальной подставке в боковой проекции с захватом нижнего отдела голени. Они должны быть по отношению друг к другу под углом 90 градусов. Нагрузкой является вес собственного тела пациента. Для этого пациент, стоя на обследуемой стопе, поднимает и сгибает в колене другую ногу. Так же с другой стопой.
На рентгенограмме измеряют высоту продольного свода стопы и угол его наклона. Для этого соединяют горизонтальной линией подошвенную поверхность головки I плюсневой кости и нижнюю точку бугра пяточной кости. Концы этой линии соединяют с наиболее низкой точкой ладьевидногоклинговидного сустава. Из данной точки опускается перпендикуляр на проведенную горизонтальную линию. Высота этого перпендикуляра - высота продольного свода стопы. Угол между косыми линиями у вершины перпендикуляра - угол свода стопы. В норме высота равна 35-39 мм, угол - 125-130о.
Различают 3 степени продольного плоскостопия, причем высота свода и угол свода бывают иногда разных степеней.
|
Форма стопы |
Угол продольного свода стопы (в градусах) |
Длина свода стпы (в мм) |
|||||||||||
|
135 |
140 |
145 |
150 |
155 |
160 |
165 |
170 |
175 |
180 |
185 |
190 |
||
|
Высота свода стопы (в мм) |
|||||||||||||
|
Полая |
90-110 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
55 |
56 |
- |
- |
- |
|
Нормальная |
111-135 |
47-27 |
48-28 |
49-29 |
50-29 |
52-31 |
53-32 |
54-33 |
55-34 |
55-35 |
|||
|
Плоскостопие I степени |
136-145 |
28-21 |
29-22 |
30-23 |
30-24 |
31-24 |
32-25 |
33-25 |
34-26 |
35-27 |
36-28 |
37-28 |
38-29 |
|
Плоскостопие II степени |
146-155 |
21 |
21-17 |
22-17 |
22-17 |
23-17 |
24-18 |
24-18 |
25-18 |
26-19 |
27-20 |
28-20 |
28-21 |
|
Плоскостопие III степени |
156-185 и более |
- |
- |
- |
15 |
16-14 |
16-11 |
17-11 |
17-11 |
18-10 |
19-10 |
19-9 |
20-9 |
Чаще всего эти сведения используются для решения экспертных вопросов в военно-врачебных комиссиях при освидетельствовании призывников и поступающих в военные учебные учреждения.
Диагностика продольного плоскостопия, особенно у детей и подростков, важна для выбора правильного лечения, коррекционной обуви, стелек, лечебной физкультуры, массажа с целью предотвращения увеличения плоскостопия и присоединения вторичных осложнений, таких как артроз, остеохондропатии, пяточные шпоры и другие.
Подготовила врач-рентгенолог Ксензова А.Ф.
При лечении различной ортопедической патологии у детей возникает необходимость удлинения ахиллова сухожилия [5; 6; 8; 9]. До настоящего времени проводится поиск эффективных и малотравматичных методик данного хирургического вмешательства.
Имеется прямая связь между техникой выполнения тенотомии, возрастом ребенка и регенерационной способностью ахиллова сухожилия. Это связано с тем, что от способа пересечения сухожилия, обширности повреждения околосухожильных тканей зависит то, в каких условиях будет происходить его регенерация [1]. Повреждение структур сухожилия, принимающих активное участие в его кровоснабжении, приводит к значительному снижению репаративных возможностей сухожильной ткани.
Современная ультразвуковая диагностика является методом выбора при изучении репарации ахиллова сухожилия у детей после оперативных вмешательств [4; 11]. Данное исследование является высокоинформативным, неинвазивным, доступным в клинической практике и может применяться так часто, как это необходимо для этапного наблюдения за динамикой изменений, происходящих в структуре ахиллова сухожилия [7; 10].
Цель настоящей работы ‒ изучение процессов регенерации ахиллова сухожилия после подкожной частичной многоуровневой поперечной тенотомии.
Материалы и методы исследования
Процессы регенерации ахиллова сухожилия изучены у 18 больных на 29 стопах с детским церебральным параличом и у 38 больных на 66 стопах с врожденной плосковальгусной деформацией стоп, которым при коррекции деформации стоп была выполнена подкожная частичная многоуровневая поперечная тенотомия ахиллового сухожилия по разработанной методике. Двусторонняя патология отмечена у 39 детей, односторонняя – у 17 (правосторонняя – 10, левосторонняя – 7). Средний возраст составил – 5,0 ± 0,7 лет.
Во всех случаях использован способ удлинения сухожилия (патент РФ № 2414864 от 27.03.2011 г.), разработанный в Нижегородском НИИ травматологии и ортопедии. Способ осуществляется следующим образом: через проколы кожи выполняют продольные разрезы в сагиттальной плоскости через всю толщину сухожилия эксцентрично его середины на 3–4 мм, чередуя отступ к наружному и внутреннему краям. Выполняют поперечные разрезы, равные по длине продольным, идущие от середины промежуточных продольных разрезов через середину сухожилия поочередно к наружному и внутреннему его краям. Из наиболее удаленных друг от друга концов дистального и проксимального продольных разрезов производят поперечные разрезы идущие к наружному и внутреннему краям сухожилия. Натягивают (напрягают) сухожилие и производят его удлинение за счет раскрытия поперечных и продольных разрезов с образованием диастазов. Расположение разрезов при частичной многоуровневой поперечной тенотомии представлено на рис. 1.
Рис. 1. Расположение продольных и поперечных разрезов при частичной многоуровневой поперечной тенотомии
В данном случае удлинение ахиллова сухожилия осуществляется за счет выполнения поперечных и продольных разрезов с сохранением непрерывной целостности сухожилия, что значительно снижает травматичность процедуры и создает благоприятные условия для регенерации. Необходимая величина удлинения легко дозируется полнотой раскрытия разрезов при натяжении сухожилия. При достижении эффекта удлинения исключается утолщение, деформация сухожилия, что снижает риск образования обширных и плотных рубцовых сращений, улучшая функциональный результат лечения.
Оценка процессов репаративной регенерации ахиллова сухожилия проводилась на аппарате Acuson X 300 (Siemens, Германия), линейными датчиками 13–5 МГц с небольшой рабочей поверхностью для удобства сканирования. Ультразвуковое исследование ахиллова сухожилия проводилось по стандартной методике [2, 3]. Определялась толщина сухожилия в проксимальной и дистальной его частях, выраженность паратенона, оценивалась его структура и формирование регенерата. Ультрасонография ахиллова сухожилия проводилась до оперативного вмешательства, а также на 7, 15, 30, 60 и 180 сутки после него.
Результаты исследования и их обсуждение
Исходная картина ахиллова сухожилия перед тенотомией при продольном ультразвуковом сканировании характеризуется наличием трубчатой структуры с параллельными гиперэхогенными линиями (рис. 2). Гиперэхогенные линии являются отражениями ультразвукового луча от коллагена и перегородок эндотелия. Ахиллово сухожилие прослеживается на всем протяжении, хорошо дифференцируется от окружающих его мягких тканей, четко определяются его контуры и волокнистая структура. При ультразвуковом сканировании по краям ахиллова сухожилия визуализируются гиперэхогенные линии – паратенон, толщина которого составляет 0,26 ± 0,05 мм.
Рис. 2. Изображение ахиллова сухожилия до подкожной тенотомии
Передне-задний размер проксимальной части сухожилия равен 3,2 ± 0,15 мм, а дистальной – 4,1 ± 0,26 мм. При поперечном сканировании ахиллово сухожилие лоцируется в виде образования овальной формы с четкими контурами и яркими гиперэхогенными точками.
На 7 сутки после тенотомии при ультразвуковом исследовании ахиллова сухожилия при продольном сканировании определяется непрерывность его контура (рис. 3).
При продольном и поперечном сканировании отмечается частичное нарушение целостности сухожилия в виде гипоэхогенных зон (p < 0,01) по сравнению с исходными данными, размеры которых составили 4,7 ± 0,42 мм и 2,7 ± 0,2 мм при сохранном интактном паратеноне. Передне-задний размер сухожилия – 4,7 ± 0,38 мм. Выявляется снижение эхогенности сухожилия и неоднородность его структуры за счет утолщения, разрыхления и набухания соединительнотканной его основы. Подкожная клетчатка утолщена, эхогенность ее снижена, что указывает на развитие отека подкожной клетчатки. При использовании энергетического допплеровского картирования (ЭДК) отмечается усиление васкуляризации.
Рис. 3. Изображение ахиллова сухожилия на 7 сутки после тенотомии
Данная ультросонографическая картина соответствует первой фазе репаративной регенерации сухожильной ткани – экссудации и фибриноидного склеивания. Утолщение, разрыхление и набухание соединительнотканной основы сухожилия свидетельствует об увеличении отека ахиллова сухожилия. Диастаз между краями частично пересеченного сухожилия заполнен остатками кровяного сгустка, фибрином с образованием соединительнотканной основы.
На 15 сутки после операции при продольном сканировании лоцируется непрерывность контура ахиллова сухожилия при сохранном паратеноне (рис. 4).
Рис. 4. Изображение ахиллова сухожилия на 15 сутки после тенотомии
По сравнению с предыдущим исследованием отмечается увеличение передне-заднего размера сухожилия до 5,0 ± 0,26 мм (p > 0,05). Сохраняются признаки умеренно сниженной эхогенности сухожилия и неоднородность его структуры, что указывает на сохраняющийся отек соединительнотканной основы сухожилия. При продольном и поперечном сканировании отмечается частичное нарушение целостности сухожилия размерами 4,2 ± 0,37 мм и 2,2 ± 0,18 мм. В этих зонах сухожилие имеет неоднородную структуру (преимущественно гипоэхогенную) и нечеткий контур, что свидетельствует о замещении лизированной гематомы новообразованной соединительной тканью – регенератом. При использовании ЭДК лоцируется перифокальный кровоток. Подкожная клетчатка имеет сниженную эхогенность.
Ультросонографическая картина соответствует началу второй фазы репаративной регенерации сухожильной ткани – фиброплазии. Сохраняющееся утолщение и разрыхление соединительнотканной основы сухожилия свидетельствует о бурной соединительнотканной пролиферации и васкуляризации в местах частичного пересечения ахиллова сухожилия. Диастаз между краями частично пересеченного сухожилия уменьшается и заполняется пролиферационной грануляционной тканью.
На 30 сутки после подкожной тенотомии при ультразвуковом исследовании ахиллова сухожилия определяется непрерывность его контура, соединительнотканная оболочка сухожилия (паратенон) прослеживается на всем его протяжении (рис. 5).
Рис. 5. Изображение ахиллова сухожилия на 30 сутки после тенотомии
По сравнению с исследованием на 15 сутки отмечается некоторое увеличение передне-заднего размера сухожилия до 5,7 ± 0,5 мм (p > 0,05), что свидетельствует о сохранении разрыхления и набухания соединительнотканной основы сухожильной ткани. При продольном и поперечном сканировании вдоль переднего края сухожилия отчетливо определяется соединительнотканный регенерат, который имеет неоднородную структуру (преимущественно гипоэхогенная) и нечеткий контур. По сравнению с 15 сутками после тенотомии протяженность гипоэхогенной зоны регенерата в продольном и поперечном размере уменьшилась и составляет 3,5 ± 0,28 и 1,9 ± 0,15 мм. Прилежащие к ахилловому сухожилию ткани (подкожная клетчатка) принимают картину нормальной эхогенности. При использовании ЭДК лоцируются единичные очаги васкуляризации.
Данная ультросонографическая картина свидетельствует о начале третьей фазы репаративной регенерации сухожильной ткани – созревания и дифференциации. Просвет между краями частично пересеченного сухожилия полностью заполняется новообразованной тканью (регенератом), происходит полимеризация фибрилл коллагена, и соединительнотканные волокна начинают приобретать сходство с сухожильными волокнами.
На 60 сутки после операции при ультразвуковом исследовании ахиллова сухожилия наблюдаются дальнейшие процессы созревания сухожильного регенерата в местах его частичного поперечного пересечения (рис. 6). Отчетливо прослеживается хорошо выраженная соединительнотканная оболочка ахиллова сухожилия (паратенон) на всем его протяжении.
Рис. 6. Изображение ахиллова сухожилия на 60 сутки после тенотомии
По сравнению с исследованием на 30 сутки отмечается дальнейшее равномерное увеличение передне-заднего размера сухожилия до 7,9 ± 0,47 мм (p > 0,05). Ахиллово сухожилие обычной эхогенности, с упорядочной эхоструктурой, с четкими ровными контурами. Зоны дефектов полностью заполнены новообразованной соединительной тканью – регенератом. Эхоструктура регенерата имеет сниженную эхогенность, четкие и ровные контуры. При ЭДК лоцируются единичные очаги васкуляризации. Прилежащие к ахилловому сухожилию ткани (подкожная клетчатка) имеют картину нормальной эхогенности.
Данная ультросонографическая картина свидетельствует о продолжении третьей фазы репаративной регенерации сухожильной ткани. При этом зоны дефектов сухожилия полностью заполнены новообразованной соединительной тканью – регенератом. Структура регенерата приближена к нормальной ткани сухожилия.
На 180 сутки после тенотомии при продольном сканировании сухожилия визуализируется линейная структура с четкими, ровными контурами, эхогенными границами, непрерывными на всем протяжении: от мышечной части до прикрепления к пяточной кости (рис. 7).
Рис. 7. Изображение ахиллова сухожилия на 180 сутки после тенотомии
Ахиллово сухожилие имеет равномерное изменение толщины по направлению от пяточного бугра к сухожильно-мышечному переходу. По сравнению с исследованием на 60 сутки отмечается незначительное уменьшение передне-заднего размера сухожилия до 7,5 ± 0,6 мм (p > 0,05). Толщина в проксимальной части сухожилия составила 6,2 ± 0,0,49 мм, а в дистальной – 4,0 ± 0,32 мм. Максимальное значение передне-заднего размера определяется в средней части ахиллова сухожилия (зона сухожильного регенерата) и составляет 7,5 ± 0,6 мм. При поперечном сканировании лоцируется образование овальной формы, с четкими эхогенными контурами. При использовании ЭДК усиленной васкуляризации не выявлено. Окружающие мягкие ткани без особенностей.
Ультросонографическое изображение соответствует полному восстановлению ахиллова сухожилия. Структура ахиллова сухожилия достаточно однородная на всем его протяжении, места частичного пересечения ахиллова сухожилия не определяются.
Заключение
Проведенное исследование позволило изучить процессы регенерации ахиллова сухожилия после его частичного многоуровневого поперечного пересечения с сохранением непрерывной целостности. Выбранная кратность УЗИ ахиллова сухожилия дала возможность проследить основные фазы репаративной регенерации сухожильной ткани.
Ультразвуковое исследование ахиллова сухожилия показало, что уже на 30 сутки после операции диастаз между краями частично пересеченного сухожилия полностью заполняется новообразованной тканью (регенератом), соединительнотканные волокна начинают приобретать сходство с сухожильными волокнами, а окончательная его перестройка наступает на 180 сутки после тенотомии.
Полученные данные свидетельствуют о том, что использование разработанного способа удлинения сухожилия, осуществляемого за счет частичного многоуровневого поперечного пересечения с сохранением его непрерывной целостности, позволяет значительно уменьшить травматичность процедуры и создать благоприятные условия для регенерации ахиллова сухожилия.
Рецензенты:
Королев С.Б., д.м.н., профессор, заведующий кафедрой травматологии, ортопедии и военно-полевой хирургии, ГБОУ ВПО НижГМА Минздрава России, г. Нижний Новгород;
Малышев Е.С., д.м.н., профессор кафедры хирургии (курс травматологии и ортопедии), ФПКВ ГБОУ ВПО НижГМА Минздрава России, г. Нижний Новгород.
Библиографическая ссылка
Власов М.В., Богосьян А.Б., Мусихина И.В., Кузнецова И.В. РЕГЕНЕРАЦИЯ АХИЛЛОВА СУХОЖИЛИЯ ПРИ ЕГО ПОДКОЖНОЙ ЧАСТИЧНОЙ МНОГОУРОВНЕВОЙ ПОПЕРЕЧНОЙ ТЕНОТОМИИ У ДЕТЕЙ // Фундаментальные исследования. – 2013. – № 11-1. – С. 27-32;
URL: https://fundamental-research.ru/ru/article/view?id=33004
Подготовила по материалам статьи ФГБУ ННИИТО Минздрава России
инструктор-методист по ЛФК Абрамовой Ю.А.
Бобат терапия — эффективная методика реабилитации пациентов с органическими поражениями головного мозга, в том числе детского церебрального паралича (ДЦП), и последствий ишемического инсульта. Применение концепции позволяет достигать результатов в виде полного восстановления двигательной активности пациентов разного возраста.
Методика разработана британскими специалистами: физиотерапевтом Бертой Бобат и нейрофизиологом Карлом Бобат в 1943 году. Путем длительных наблюдений за пациентами со спастическими нарушениями мускулатуры Берта выявила закономерность в эффективном взаимодействии психики и тела в лечении и укреплении всего организма, а не отдельных его частей. А Карл как профессор психотерапии и нейрофизиологии научно обосновал концепцию нейродинамической реабилитации и создал практический алгоритм ее применения в работе с пациентами.
Концепция помогает тысячам пациентов с нарушениями ЦНС по всему миру повысить качество жизни и двигаться самостоятельно. Студенты МАМР, обучаясь у европейских специалистов-практиков Бобат, становятся востребованными реабилитологами и могут работать с самыми сложными случаями спастических нарушений как со взрослыми, так и с детьми.
Показания к Бобат терапии
Применение Бобат терапии рекомендовано при следующих патологиях:
- ДЦП
- Задержка психомоторного развития.
- Спазмирование конечностей.
- Нарушения движения и равновесия.
- Опухоли и воспаления головного мозга.
- Последствия инсульта.
- Рассеянный склероз.
При всех этих заболеваниях применение техник Бобат терапии дает результаты в виде повышения качества двигательной активности.
Принцип действия Бобат терапии
Концепция основана на выработке у пациента управляемых, рациональных и осознанных движений, которые позволяют снижать мышечные спазмы.
Так как мозг человека пластичен, он способен к реорганизации, то есть здоровый участок мозга может обучаться и выполнять задачи, которые ранее выполнялись поврежденным участком мозга. С помощью комплекса физических упражнений и мануальных техник тело больного обучается заново выполнять необходимые движения самостоятельно.
Лечение по методике Бобат предполагает постепенную адаптацию пациента к нормальному образу жизни без физического дискомфорта.
Основные принципы Бобат терапии для взрослых и детей:
- Безболезненность — упражнения не должны доставлять пациенту никакой боли или дискомфорта.
- Регулярность — для получения результатов терапия должна выполняться ежедневно.
- План лечения — реабилитационные мероприятия выполняют исходя из динамических возможностей пациента.
- Разнообразие упражнений — Бобат терапию проводят с постепенным усложнением упражнений.
- Непрерывный контроль со стороны лечащего врача и инструктора ЛФК, в ряде случаев к лечению подключают неврологов, ортопедов и нейрохирургов.
Реабилитация пациентов с помощью Бобат терапии предполагает работу терапевта с использованием специального стола, матов, мануальные техники и обучение движениям.
Во время упражнений задействованы ослабленные и парализованные части тела. Происходит обучение пациента восприятию своего положения в пространстве и контролю движений всей мускулатуры.
Для достижения результатов пациентам нужно научиться самостоятельно контролировать мышечный тонус, правильно применяя навыки напряжения и расслабления, выполнять движения по психомоторному стереотипу, что позволяет вернуть координацию.
Особенности Бобат терапии для детей
Методику можно применять для реабилитации детей в первый год жизни. В это время мозг наиболее быстро адаптируется к изменениям, и тело активно учится правильным самостоятельным движениям. Занятия предусматривают игровую форму, чтобы ребенок мог пробовать, щупать и играть с разными предметами, развивая мелкую моторику. С ростом числа взаимодействий с элементами внешнего мира, тем больше участков головного мозга активизируется в комплексе со всем организмом. Если ребенок развивается медленно и к 9 месяцам не сидит самостоятельно, следует обратиться к неврологу и начать курс Бобат терапии для развития моторики и сенсорики.
Бобат терапия в лечении ДЦП
Лечебная физкультура по Бобат способствует развитию у детей с церебральным параличом навыков игры и движений, обучает уходу за собой, развивает привычки, соблюдение которых обязательно в быту. Упражнения позволяют снять мышечное напряжение и способствуют восстановлению нормальной двигательной активности.
Рассмотрим пример комплекса упражнений из Бобат концепции для детей с ДЦП.
В начале упражнений ребенок лежит на спине в состоянии напряжения в теле и конечностях:
- Расслабляем кисть руки. Берем большой палец парализованной кисти и перемещаем в направлении наружной части кисти. Удерживаем большой палец в новой для него позиции до 3 минут, чтобы расслабить мышцы кисти.
- После снятия спазмов и расслабления мышц берем кончики пальцев кисти, и разгибаем их, не прикасаясь к ладони.
- После распрямления пальцев спастической кисти сгибаем и разгибаем запястье, отводим его без перемены положения большого пальца.
- Далее сгибаем плечо, удерживая большой палец в отведенном состоянии. Руку выводим вперед, сгибая плечо. После сгибания плеча под максимальным углом, удерживаем руку в полученном положении до наступления мышечной релаксации.
- Сгибаем и разгибаем ноги. Для этого отгибаем большой палец парализованной ноги ребенка вверх, фиксируем в этом положении, пока спазмированная нога ребенка не расслабится. Одной рукой давим над коленом, а другой рукой тянем стопу вверх, а потом вниз. Отводим ногу. Максимально выпрямляем ноги при согнутой стопе. Давим на внутреннюю сторону колена, одновременно вытягиваем ногу.
- Нога должна быть в согнутом состоянии. Одной рукой удерживаем палец стопы с отведением вверх, другой рукой давим на колено в направлении нужного движения. Медленно, без изменений темпа, отклоняем колено на максимальный угол.
- Голеностоп сгибаем, затем разгибаем. Одной рукой удерживаем большой палец ноги в отведении вверх, другой рукой помогаем ребенку сгибать и разгибать стопу.
Упражнения выполняют медленно, с перерывами. Результат достигается за счет регулярности и непрерывности процедур. Для удержания нужного положения тела могут применяться ортотики — специальные ортопедические приспособления в виде стульчиков, вертикализаторов, ортезов, которые помогают быстрее восстановить двигательную активность ребенка.
В МАМР большое внимание уделено обучению специалистов Бобат терапии для детей с рождения. Европейские специалисты-практики Анна Гогола и Гнат Рафал на своих курсах и семинарах кроме диагностики и упражнений по этой концепции обучают мануальным практикам при тесном взаимодействии с неврологами, ортопедами, нейрохирургами. Обучают терапии с помощью специального ортопедического оборудования
Бобат терапия в реабилитации инсульта
Восстановление пациента после инсульта строится на постоянном взаимодействии с реабилитологом. Доктор дает пациенту возможность восстановить двигательную активность через «новый путь», пользуясь пластичностью нервной системы. В этой концепции организм человека рассматривают как единую систему, где все мышцы и ткани взаимосвязаны. И, воздействуя на здоровую часть тела, можно постепенно вернуть подвижность пораженной.
Упражнения направлены на снижение чрезмерного напряжения мышц. В основе метода лежит растяжение мышц-разгибателей. В курсе лечебной гимнастики предусмотрен большой спектр упражнений на растяжение и укрепление мышц с целью возвращения чувствительности и самостоятельного управления телом.
Результаты лечения у взрослых
Каждое действие методики направлено на достижение пациентом одной из следующих целей:
- Ингибиция — пациент может самостоятельно удерживать непроизвольные движения тела.
- Фасилитация — с использованием направляющих движений по растяжке и расслаблению мышц тело пациента запоминает, как именно нужно двигаться.
- Достижение самостоятельности. В занятия включаются разные элементы обслуживания себя, которые пациент должен освоить, чтобы обходиться без помощи родственников.
подготовил инструктор-методист по ЛФК Бредихин Н.С.
Отечественный механотерапевтический тренажер для непрерывной разработки суставов.
Позволяет мобилизовать конечности на самых ранних этапах реабилитации за счет двигателя.
Используется для предотвращения осложнений иммобилизации, для раннего восстановления безболезненной подвижности суставов.
ОБОРУДОВАНИЕ СЕРТИФИЦИРОВАНО И ЗАРЕГИСТРИРОВАНО В МИНЗДРАВЕ РФ
⦁ Простота управления и настроек;
⦁ Пульт дистанционного управления с сенсорным экраном;
⦁ Настройка диапазона движений в реальном времени;
⦁ Расширенные настройки терапии.
Аппарат используются во время первой фазы реабилитации, следующей после травм или операций нижних конечностей, длительно и многократно разрабатывает суставы с помощью контролируемого диапазона движений.
Ежедневная терапия улучшает изначально ограниченную подвижность сустава и предотвращает такие негативные последствия неподвижности суставов, как потеря гибкости, отёчность, недостаточность питания суставных хрящей, потеря коллагена и тромбоэмболия.
Терапия непрерывными пассивными движениями обеспечивает безопасную разработку суставов на протяжении всего периода восстановления и заживления тканей, что способствует уменьшению боли и минимизации риска воспаления, помогает повысить уровень подвижности и благоприятно влияет на состояние мышц, стимулирует метаболизм хондроцитов, что крайне важно для регенерации суставов.
Использование Аппарата способствует снижению употребления лекарственных препаратов, более быстрой выписке из больницы, сокращению амбулаторного ухода и снижению затрат на реабилитацию в целом.
подготовил инструктор-методист по ЛФК Бредихин Н.С.
Дисплазия соединительной ткани – группа полиморфных в клиническом отношении патологических состояний, обусловленных наследственными или врожденными дефектами синтеза коллагена и сопровождающихся нарушением функционирования внутренних органов и опорно-двигательного аппарата. Наиболее часто соединительнотканная дисплазия проявляется изменением пропорций тела, костными деформациями, гипермобильностью суставов, привычными вывихами, гиперэластичной кожей, клапанными пороками сердца, хрупкостью сосудов, мышечной слабостью. Диагностика основана на фенотипических признаках, биохимических показателях, данных биопсии. Популяционная частота соединительнотканной дисплазии составляет 7-8%, однако предполагается, что отдельные ее признаки и малые недифференцированные формы могут встречаться у 60-70% населения. Соединительнотканная дисплазия попадает в поле зрения клиницистов, работающих в разных медицинских областях – педиатрии, неврологии, травматологии и ортопедии, ревматологии, кардиологии, офтальмологии, гастроэнтерологии, иммунологии, пульмонологии, урологии и др.
Классификация.
Соединительнотканная дисплазия подразделяются на дифференцированные и недифференцированные. К числу дифференцированных дисплазий относятся заболевания с определенным, установленным типом наследования, четкой клинической картиной, известными генными дефектами и биохимическими нарушениями. Наиболее типичными представителями данной группы наследственных заболеваний соединительной ткани служат синдром Элерса-Данлоса, синдром Марфана, несовершенный остеогенез, мукополисахаридозы, системный эластоз, диспластический сколиоз, синдром Билса (врожденная контрактурная арахнодактилия) и др. Группу недифференцированных соединительнотканных дисплазий составляют различные патологии, чьи фенотипические признаки не соответствуют ни одному из дифференцированных заболеваний.
По степени выраженности выделяют следующие виды соединительнотканных дисплазий: малые (при наличии 3-х и более фенотипических признаков), изолированные (с локализацией в одном органе) и собственно наследственные заболевания соединительной ткани. В зависимости от преобладающих диспластических стигм различают 10 фенотипических вариантов соединительнотканной дисплазии:
1. Марфаноподо6ная внешность (включает 4 и более фенотипических признака скелетной дисплазии).
2. Марфаноподо6ный фенотип (неполный набор признаков синдрома Марфана).
3. МАSS-фенотип (включает поражение аорты, митрального клапана, скелета и кожи).
4. Первичный пролапс митрального клапана (характеризуется ЭхоКГ-признаками митрального пролапса, изменениями со стороны кожи, скелета, суставов).
5. Классический элерсоподобный фенотип (неполный набор признаков синдрома Элерса-Данлоса).
6. Гипермобильный элерсоподобный фенотип (характеризуется гипермобильностью суставов и сопутствующими осложнениями: подвывихами, вывихами, растяжениями, плоскостопием; артралгиями, вовлечением костей и скелета).
7. Гипермобильность суставов доброкачественная (включает повышенный объем движений в суставах без заинтересованности костно-скелетной системы и артралгий).
8. Недифференцированная соединительнотканная дисплазия (включает 6 и более диспластических стигм, которых, однако, недостаточно для диагностики дифференцированных синдромов).
9. Повышенная диспластическая стигматизация с преимущественными костно-суставными и скелетными признаками.
10. Повышенная диспластическая стигматизация с преимущественными висцеральными признаками (малыми аномалиями сердца или других внутренних органов).Клинические проявления ДСТ во многом связаны с ведущим клиническим
синдромом, затрагивающим ту или иную систему организма. На сегодняшний день выделено 28 синдромов при ДСТ: синдром расстройства вегетативной нервной системы, бронхолегочный синдром, синдром иммунологических нарушений, косметический синдром, тромбогеморрагический синдром, синдром обменных нарушений в миокарде,
клапанный и аритмический синдромы, синдром синкопальных состояний, торако-диафрагмальный синдром, вертеброгенный синдром, синдромы органа зрения, астенический синдром, синдром торако-диафрагмального сердца, патологии стопы , хронической артериальной гипотонии, синдром артериальной гипертонии, сосудистый синдром, синдромы патологии пищеварительной, мочевыделительной и репродуктивных систем, синдром анемии, синдром психических расстройств и расстройств поведения, синдром внезапной смерти, синдром гирпермобильности суставов, сидром диспластической полинейропатии.
Диагностика.
Заболевания из группы соединительнотканных дисплазий не всегда диагностируются правильно и своевременно. Часто больные с теми или иными признаками дисплазии наблюдаются у врачей разных специальностей: травматологов, неврологов, кардиологов, пульмонологов, нефрологов, гастроэнтерологов, офтальмологов и др. У всех детей с ДСТ обнаруживаются так называемые малые аномалии развития, или дисморфии. К наиболее часто встречающимся дисморфиям относятся: светлокожесть, сросшиеся брови, широкая переносица, гипер-и гипотелоризм, голубые склеры, эпикант, неправильный рост зубов, деформированная ушная раковина, приросшая мочка, изогнутые мизинцы, неполная синдактилия пальцев, светлый или рыжий цвет волос. Диагностически значимым для выявления НДСТ является наличие у ребенка 6 и более дисморфий. Распознавание недифференцированных форм соединительнотканной дисплазии усложняется отсутствием единых алгоритмов диагностики.
Наибольшей диагностической значимостью обладает выявление совокупности фенотипических и висцеральных признаков. С целью обнаружения последних широко применяются ультразвуковые (ЭхоКГ, УЗИ почек, УЗИ органов брюшной полости), эндоскопические (ФГДС), электрофизиологические (ЭКГ, ЭЭГ), рентгенологические (рентгенография легких, суставов, позвоночника и др.) методы. Выявление характерных полиорганных нарушений, главным образом, со стороны опорно-двигательной, нервной и сердечно-сосудистой систем с высокой степенью вероятности свидетельствует о наличии соединительнотканной дисплазии.
Дополнительно исследуются биохимические показатели крови, система гемостаза, иммунный статус, проводится биопсия кожи. В качестве метода скрининг-диагностики соединительнотканной дисплазии предложено проводить исследование папиллярного рисунка кожи передней брюшной стенки: выявление неоформленного типа папиллярного рисунка служит маркером диспластических нарушений. Семьям, где имеются случаи соединительнотканной дисплазии, рекомендуется пройти медико-генетическое консультирование.
Лечение соединительнотканной дисплазии.
Специфического лечения соединительнотканной дисплазии не существует. Универсальное средство, восстанавливающее соединительную ткань при любых формах дисплазий, еще не найдено. Для каждого ребенка с ДСТ подбирается индивидуальная программа лечения. Три ее основные задачи: улучшение обменных процессов соединительной ткани, устранение уже возникших осложнений и профилактика новых. В любом случае речь идет о фактически согласованной работе мультидисциплинарной команды. И об очень сложном, комплексном лечении, которое затрагивает весь детский период жизни (в РФ — до 18 лет). Немедикаментозная терапия включает строгое соблюдение ребенком режима, в том числе питания, где акцент делается на потреблении полноценных белков и продуктов, содержащих полиненасыщенные жирные кислоты; и физической активности, отдельные виды которой таким пациентам запрещены. Существует перечень профессий, к которым нельзя готовить школьников, страдающих ДСТ. В комплексе лечебных мероприятий, наряду с синдромальной медикаментозной терапией, используются метаболические препараты (L-карнитин, коэнзим Q10), препараты кальция и магния, хондропротекторы, витаминно-минеральные комплексы, антиоксидантные и иммуномодулирующие средства, фитотерапия, психотерапия.
Прогноз
Прогноз соединительнотканной дисплазии во многом зависит от степени выраженности диспластических нарушений. У пациентов с изолированными формами качество жизни может не нарушаться. У больных с полисистемным поражением повышен риск ранней и тяжелой инвалидизации, преждевременной смерти, причинами которой могут выступать фибрилляция желудочков, ТЭЛА, разрыв аневризмы аорты, геморрагический инсульт, тяжелые внутренние кровотечения и др.
подготовила врач-невролог Котова О.С.
Стадия 1 (рождение — 3 месяца): недифференцированная реакция на людей.
В первые 2–3 месяца жизни ребенок реагирует на людей определенным образом, однако его способность отличать одного человека от другого или совсем отсутствует, или очень ограничена.
Сразу же после рождения малышам нравится слушать человеческие голоса и смотреть на человеческие лица. К примеру, одно исследование показывает, что малыши, родившиеся всего лишь 10 минут назад, предпочитают лицо другим зрительным раздражителям; они в значительно большей степени изменяют положение головы, когда следят за точной моделью лица, нежели, когда следят за отдаленным подобием лица или за чистым листом бумаги. Этологам, таким как Джон Боулби, это предпочтение дает основание говорить о генетической настроенности зрительной системы на специфический паттерн, который вскоре будет выполнять роль релизора для одного из наиболее эффективных видов поведения привязанности – социальной улыбки.
В течение первых 3 недель или около того малыши иногда улыбаются с закрытыми глазами, обычно перед тем, как заснуть. Эти улыбки еще не являются социальными; они не направлены на людей. Примерно в 3-недельном возрасте дети начинают улыбаться при звуке человеческого голоса. Это социальные улыбки, но они по-прежнему мимолетны.
Наиболее впечатляющие социальные улыбки появляются в возрасте 5–6 недель. Малыши улыбаются счастливо и широко при виде человеческого лица, и их улыбка включает в себя контакт глаз. Можно угадать, когда такие визуальные улыбки вот-вот появятся. Примерно за неделю до этого малыш начинает внимательно всматриваться в лица, как бы изучая их.
Затем лицо малыша озаряет широкая улыбка. В жизни родителя этот момент часто оказывается окрыляющим; родитель теперь имеет «доказательство» любви малыша. При виде малыша, смотрящего вам прямо в глаза и улыбающегося, вас начинает переполнять глубокое чувство любви. (Даже если вы не родитель, то могли испытывать схожее чувство, когда вам улыбался младенец. Вы не можете не улыбнуться в ответ и вам кажется, что между вами и малышом устанавливается какая-то особая связь).
Фактически, примерно до 3-месячного возраста малыши будут улыбаться любому лицу, даже его картонной модели. Главное условие состоит в том, чтобы лицо было видно полностью или в фас.
Профиль намного менее эффективен. Кроме того, на этой стадии голос или ласка являются относительно слабыми инициаторами улыбки. Поэтому представляется, что социальную улыбку малыша вызывает довольно специфический зрительный раздражитель.
По мнению Боулби, улыбка способствует привязанности потому, что поддерживает сохранение пространственной близости между ребенком и ухаживающим за ним взрослым. Когда малыш улыбается, заботящийся о нем взрослый наслаждается тем, что находится рядом с младенцем, «улыбается в ответ, разговаривает с ним, гладит и похлопывает его, и, возможно, берет его на руки». Улыбка сама является релизором, который активизирует любящее и заботливое взаимодействие — поведение, повышающее шансы ребенка на то, что он будет здоровым и жизнеспособным.
Примерно в тот период, когда дети начинают улыбаться лицам, они также начинают гулить. Они гулят в основном при звуке человеческого голоса, и особенно при виде человеческого лица. Как и в случае улыбки, гуление первоначально не избирательно; малыши гулят практически независимо от того, какой человек находится рядом. Издаваемые младенцем звуки радуют ухаживающих за ним взрослых, побуждая их что-то говорить в ответ. «Гуление, как и улыбка, является социальным релизором, который выполняет функцию удержания материнской фигуры в непосредственной близости от младенца, способствуя социальному взаимодействию между ними».
Плач также имеет результатом приближение родителя к ребенку. Плач подобен сигналу бедствия; он оповещает, что малышу требуется помощь. Дети плачут, когда испытывают боль, дискомфорт, голодны или озябли. Они даже плачут, если человек, на которого они смотрели, удаляется из их поля зрения, причем в первые недели жизни не имеет особого значения, кто этот человек. Малыши также позволят почти любому человеку успокоить их, покачав или удовлетворив их потребности.
Малыш также поддерживает близость путем цепляния. Новорожденный наделен двумя удерживающими реакциями. Одна — это хватательный рефлекс; когда открытой ладони малыша касается любой объект, рука автоматически его сжимает. Другой — рефлекс Моро, который имеет место либо когда малышей пугает громкий звук, либо когда они внезапно теряют опору (например, когда кто-то приподнимает им голову, а затем неожиданно ее отпускает). Они реагируют, выпрямляя и разводя руки в стороны, а затем притягивая их назад и обхватывая свою грудь. Это действие похоже на то, как если бы малыш что-то обхватывал. В далеком прошлом, рассуждал Боулби, эти рефлексы помогали малышам держаться за родителя, который носил их на себе. Если, к примеру, мать видела
хищника и пускалась бежать, малыш должен был ухватиться рукой за какую-то часть ее тела. И если малыш случайно отпускал руку, он обнимал мать снова.
Новорожденные также наделены поисковым (rooting) и сосательным рефлексами.
Когда кто-то касается их щеки, они автоматически поворачивают голову в ту сторону, откуда последовала стимуляция, и затем «ищут» – совершают губами нащупывающие движения, пока их рот не касается чего-то такого, что можно сосать. Далее запускается сосательный рефлекс. Поисковый и сосательный рефлексы, очевидно, облегчают кормление грудью, но Боулби также рассматривал их как паттерны привязанности, так как они приводят к взаимодействию малыша с матерью.
Материал подготовила медицинский психолог Пантелеева Э.В.,
по материалам ИРАВ
Болезнь Краббе (острая детская лейкодистрофия, глобоидноклеточная лейкодистрофия, галактозилцерамидный липидоз) – редкая наследственная патология, связанная с расстройством обмена липидов и разрушением миелина в периферических нервах и ЦНС. Впервые описана немецким врачом Р. Бенеке, однако свое название получила в честь датского невропатолога К. Краббе, подробно изложившего симптоматику и патоморфологию заболевания. В популяции встречается с частотой 1:100 000 новорожденных (чаще у израильских друзов – 1:6000 и скандинавов ‒ 1:50000). Половых различий не отмечено. Течение болезни – неуклонно прогрессирующее. Классический вариант патологии развивается в первое полугодие жизни, манифестирует с гипервозбудимости, лихорадочного синдрома, мышечной спастичности, судорог, задержки психомоторного развития. Болезни Краббе свойственен полиморфизм клинических вариантов течения.
В зависимости от возраста дебюта дифференцируют 4 формы заболевания:
инфантильная (младенческая) – классическая форма, на долю которой приходится до 90% всех случаев. Развивается в возрасте 3-6 месяцев.
поздняя инфантильная (поздняя младенческая) – дебют заболевания от 6месяцев до 3 лет
ювенильная (юношеская) – признаки болезни Краббе появляются с 3-х до 12 лет
взрослая – клиническая манифестация начинается в постпубертатном периоде.
Симптомы болезни Краббе
Инфантильная форма
Начальные признаки острой детской лейкодистрофии появляются в первом полугодии жизни ребенка. Первые симптомы неспецифичны. Ребенок часто плачет, отказывается от еды, постоянно срыгивает, плохо прибавляет в массе. Отмечается высокий мышечный тонус, беспричинные эпизоды гипертермии. Уже к 6-8 мес. дети начинают отставать в психофизическом развитии: перестают держать голову, переворачиваться. На этом этапе могут присоединиться судороги. Часто описанные симптомы принимаются детскими врачами за ДЦП, поэтому диагноз болезни Краббе редко выставляется своевременно. Дальнейшее прогрессирование генетической патологии сопровождается распадом уже имеющихся у ребенка моторных навыков, остановкой умственного развития. Возникают миоклонии, опистотонус, резкое снижение сухожильных рефлексов. Развивается атрофия зрительных нервов, слепоглухота. Отмечается гипотрофия, доходящая до самой крайней степени – кахексии.
На терминальной стадии болезни Краббе развивается бульбарный паралич, что приводит к полному обездвиживанию, потере речи, невозможности глотания. Прогрессирует церебральная дегенерация. Большинство детей не доживает до 2-хлетнего возраста.
Поздняя инфантильная форма
Дебютирует в раннем детском возрасте (до 3-х лет). Характерна быстрая атрофия зрительного нерва с развитием частичной или абсолютной слепоты. В начальном периоде отмечается постепенное интеллектуальное снижение, расстройство двигательных навыков, атаксия. В дальнейшем присоединяется спастическая тетраплегия, деменция. Смерть наступает в возрасте до 7 лет.
Ювенильная и взрослая формы
Болезнь Краббе с поздним дебютом обычно начинается с ухудшения зрительной функции: развивается гемианопсия, зрительная агнозия. Больные испытывают трудности при выполнении произвольных движений. Со временем нарастает спастическая ригидность мышц нижних конечностей, проявления мозжечковой атаксии. Развивается геми- или парапарез, периферическая полинейропатия. Прогрессирование галактозилцерамидного липидоза идет медленнее, однако прогноз все равно неутешителен.
Осложнения
Тяжелые последствия болезни Краббе обусловлены прогрессирующим снижением двигательных и когнитивных функций. По мере нарастания обездвиживания часто возникают рецидивирующие респираторные инфекции. Дисфагия может приводить к аспирационной пневмонии. Возможно формирование вторичной гидроцефалии. На поздних стадиях заболевания больные прикованы к постели, недееспособны, в терминальной стадии впадают в вегетативное состояние. Гибель больных обычно наступает по причине дыхательной недостаточности, инфекционных осложнений.
Лечение болезни Краббе
Патология не поддается излечению, поэтому все меры носят симптоматическую направленность. Проводится поддерживающая противосудорожная, дегидратационная, ферментная терапия. Для улучшения двигательной функции показаны лечебная гимнастика и физиотерапевтические процедуры. В целях сохранения самообслуживания проводятся занятия по эрготерапии.
При невозможности самостоятельного питания налаживается кормление через назогастральный зонд или гастростому. Выраженная дыхательная недостаточность требует вспомогательной респираторной поддержки вплоть до наложения трахеостомы и ИВЛ.
Подготовила врач-невролог Котова О.С.
Болезнь Фабри – наследственное заболевание, при котором дефект в структуре генов обуславливает недостаточную активность или отсутствие фермента α-галактозидазы A, накопление в органах промежуточных продуктов липидного обмена. Симптоматика включает боли в конечностях, уменьшение потоотделения, депрессию, быструю утомляемость, почечную и сердечную недостаточность, острые нарушения мозгового кровообращения. Для диагностики используется исследование активности фермента и количества гликосфинголипидов в крови и тканях, секвенирование генетического материала. Лечение основано на ферментозаместительной терапии. Болезнь Фабри получила свое название по фамилии немецкого врача-дерматолога Джона Фабри, который в 1898 году подробно описал симптомы патологии у мальчика 13 лет. В это же время схожий клинический случай был выявлен врачом-дерматологом из Великобритании Вильямом Андерсеном, поэтому заболевание имеет другое распространенное название – болезнь Андерсона-Фабри. Менее известные синонимы – церамидтригексозидоз, диффузная универсальная ангиокератома, наследственный дистонический липидоз.
Эпидемиология зависит от расовой и этнической принадлежности, составляет 1 случай на 40-120 тыс. новорожденных. Наиболее высокая распространенность определяется в США.
Заболевание обусловлено мутацией гена GLA, который кодирует структуру фермента альфа-галактозидазы А, участвующего в расщеплении гликосфинголипидов. Ген локализован на длинном плече Xq 22.1 хромосомы. В результате научных исследований выявлено 599 вариантов мутаций и полиморфизмов гена, которые изменяют стабильность и активность галактозидазы. Самые распространенные причинные мутации – миссенс и нонсенс, на их долю приходится до 93% случаев болезни.
Механизм наследования патологии определен как рецессивный X-сцепленный, но продолжает изучаться. У гемизиготных мужчин присутствует единственная мутантная X-хромосома. Такой набор представляет классический фенотип заболевания. Больные мужчины способны передать мутацию только дочерям, сыновья остаются здоровыми. Дочери, получившие измененные гены от родителя, являются гетерозиготными и, согласно закону рецессивного наследования, должны оставаться клинически здоровыми – носителями. Вероятность передачи патологического аллеля от матери детям обоих полов составляет 50%.
В ходе клинических исследований установлено, что у большинства женщин с рецессивным мутантным геном болезнь проявляется симптомами умеренной выраженности, имеет позднее начало и медленное прогрессирование. У части пациенток выявляются тяжелые проявления патологии, которые требуют неотложной медицинской помощи. Причины развития тяжелых форм заболевания у гетерозиготных женщин остаются неизвестными. Возможно существование феномена инактивации нормальной X-хромосомы.
Классификация.
Поскольку патология является генетической, ее начало приходится еще на внутриутробный период. Из-за относительно медленного прогрессирования симптоматика проявляется гораздо позже – к 6-12 или даже к 30 годам. С учетом времени дебюта заболевания и характера поражения внутренних органов выделяют две формы болезни:
Классическая. Начинается в детстве и раннем подростковом возрасте. Проявляется полиорганным поражением.
Атипичная. Симптомы дебютируют в зрелом возрасте. Часто наблюдается изолированное повреждение одного органа: почек, сердца, мозга. У представителей мужского пола признаки более выраженные.
Женская. Данная форма выделяется в англоязычной литературе. Для нее характерно медленно прогрессирующее течение со слабовыраженной симптоматикой, отсутствие ведущего пораженного органа.
Особенности клинической картины в детском возрасте.
Первые клинические проявления чаще всего возникают в подростковом и юношеском возрасте, хотя иногда признаки заболевания могут дебютировать и в 2-4 года. Ранние проявления болезни Фабри могут быть неспецифическими, что значительно затрудняет диагностику. Первыми проявлениями у детей могут быть боль, дискомфорт в животе, неоформленный стул, сухость кожных покровов, плохая переносимость жары, иногда приводящая к развитию обмороков, эпизодические боли в стопах или кистях. Если боли в руках дебютируют в раннем возрасте, их очень сложно верифицировать, т.к. эпизоды болей выглядят как истерика, психомоторное возбуждение. Косвенным признаком болей в пользу периферической акропарестезии при болезни Фабри является то, что ребенок успокаивается в прохладной воде (бассейн), или наступает облегчение, если больной ложится на холодную поверхность (напр., кафельный пол). В дальнейшем жалобы на боли в конечностях становятся более частыми и постепенно приобретают типичные для болезни Фабри проявления. Цереброваскулярные нарушения у детей с риском развития инсульта являются редкими проявлениями, хотя в литературных данных есть информация о случаях преходящих нарушений мозгового кровообращения с 12 лет. Гастроэнтерологические проявления болезни могут быть одним из первых симптомов заболевания в детском и юношеском возрасте и возникать на первом десятилетии жизни, но они являются косвенными маркерами болезни Фабри в силу малой специфичности без сочетания с другими симптомами. Наиболее часто наблюдаются схваткообразные боли в животе, вздутие живота, неустойчивый стул, тошнота, рвота, снижение аппетита и дефицит МТ. К редко встречающимся и менее специфичным симптомам болезни Фабри у детей относятся особенности внешности (изменения по типу акромегалии), нарушения дыхания, анемия, скелетные аномалии (деформация дистальных отделов межфаланговых суставов пальцев рук с нарушением их подвижности, утолщение концевых фаланг пальцев по типу «барабанных палочек»), остеопения, остеопороз, трещины и эритематозные изменения грибовидных сосочков на дорсальной поверхности языка; глоссит, гранулематозный хейлит, гипотиреоз, задержка полового развития, приапизм.
Летальные исходы чаще всего связаны с почечной недостаточностью, заболеваниями сердца или инсультом.
Подготовила врач-невролог Котова О.С.
Олигофрения
При эндогенной олигофрении ЭЭГ обычно в пределах возрастной нормы. При экзогенной олигофрении на ЭЭГ обычно выявляются грубые изменения, свидетельствующие о дисфункции мезо-диэнцефальных структур.
- Дезорганизация альфа-ритма или его отсутствие;
- Диффузные медленные волны с преобладанием в центрально-теменной области;
- Преобладание гиперсинхронного тета-ритма в сочетании с генерализованными дельта-волнами;
- Вспышки гиперсинхронных, высокоамплитудных, билатерально-синхронных тета-волн и пароксизмальных разрядов с преобладанием в центральных областях.
Задержка психомоторного развития
При явлениях задержки психомоторного развития на ЭЭГ определяются ослабление восходящих влияний активирующей ретикулярной формации и дефицит регуляторных влияний лобных отделов коры.
- Дезорганизация или гиперсинхронизация альфа-ритма с увеличением амплитуды альфа-волн и смещение фокуса альфа-активности из затылочных отделов в теменные с замедлением активности;
- Преобладание на ЭЭГ медленных волн с наибольшей выраженностью в затылочных отделах;
- Ослабление и кратковременность реакций активации;
- Усиление реакции на гипервентиляцию;
- Иногда отмечаются вспышки билатерально-синхронных тета-волн в передне-центральных областях с тенденцией к генерализации, усиливающиеся при проведении гипервентиляции;
- Высокоамплитудные бета-волны частотой 16-18 Гц в передне-центральных отведениях амплитудой 30-40 мкВ.
Психопатологические нарушения
- Снижение амплитуды и индекса альфа-активности со смещением фокуса активности из затылочных в теменные отделы;
- Увеличение индекса тета-активности с преобладанием в центральных отделах;
- Ослабление реакции активации;
- Усиление кожно-гальванической реакции;
- Увеличение амплитуды вертекс-потенциала в ответ на афферентные раздражители;
- Усиление реакции усвоения ритма с преимущественным фокусом усвоения в передних областях;
- Высокоамплитудная билатерально-синхронная тета-активность частотой 5-7 Гц с преимущественным преобладанием во фронтальных и префронтальных областях коры (иногда с доминированием в центрально-височных областях при выраженных изменениях поведения).
Возбудимый тип психопатий
Замедления частоты альфа-активности при нормальной его синхронизации.
Билатерально-синхронные вспышки медленных волн. Преобладание тета-активности в передних отделах.
Тормозной тип психопатий
Десинхронизация ЭЭГ с уменьшением частоты и индекса альфа-ритма. Преобладание реакции усвоения ритма в передних отделах мозга.
Неврозы
Типы ЭЭГ при неврозах:
Первый тип
- Повышение синхронизации альфа-ритма по всем отделам мозга.
- Быстрое угасание реакции активации.
- Усвоение ритма в диапазоне низких частот с перемещением фокуса усвоения в передние отделы.
Второй тип
- Десинхронизация ЭЭГ с преобладанием бета-активности по всем областям мозга.
- Ослабление реакции активации.
- Генерализованная реакция усвоения ритма в широком диапазоне частот.
Третий тип
- Слабая выраженность альфа-активности.
- Большое количество полиморфных медленных волн.
- Ослабление реакций на раздражители.
- Пароксизмальные вспышки медленноволновой активности.
Неврозоподобный синдром
Усиление реакции активации и реакции усвоения ритма в диапазоне низких частот
Смещение фокуса реакции усвоения ритма в передние отделы мозга
Усиление синхронизации альфа-ритма и большое количество тета-волн в центральных отделах мозга.
Подготовила врач-психолог Зинина А.Г.
Согласно классификации Кобба, выделяется пять групп сколиозов.
- I группа. Сюда относятся сколиозы мышечного (миопатического) происхождения. Основой таких искривлений является недостаточное развитие мышц и связок. Группа также может включать и рахитические сколиозы — эти сколиозы появляются в результате дистрофического процесса не только в скелете, но и в нервно-мышечной ткани.
- II группа. Она включает сколиозы неврогенного происхождения (причины — полиомиелит, спастический паралич, нейрофиброматоз, сирингомиелия). Сюда можно включить также сколиозы, вызванные радикулитом, болями в пояснице, изменениями в межпозвонковых дисках, которые ведут к сдавливанию корешков.
- III группа. Это сколиозы из-за аномалий развития ребер и позвонков и ребер. Она включает все врожденные сколиозы, которые возникли из-за костных нарушений развития.
- IV группа. Это сколиозы из-за заболеваний грудной клетки (например, из-за ожогов или пластических операций на грудной клетке).
- V группа. Сюда включают идиопатические сколиозы, происхождение которых в настоящее время остается не исследованным.
Степень тяжести сколиоза определяется величиной S-образного искривления позвоночника. Для получения числовой характеристики искривления делается рентгеновский снимок. Затем на верхнем участке искривления перпендикулярно позвоночнику проводятся две линии — у верхнего и нижнего позвонков, между которыми заключено искривление. Далее строятся две линии, перпендикулярные этим. Угол между вторыми линиями в градусах — это и есть мера степени искривления. Если позвоночник абсолютно прямой, то первые две линии будут горизонтальными, а две вторые — вертикальными (и потому параллельными между собой). Если позвоночник искривлен, то первые две линии будут образовывать угол, а потому угол между собой будут образовывать и вторые две линии.
Согласно методу Джона Кобба, в нормальном случае угол между параллельными прямыми считается равным 0 градусов, и потому у слабых сколиозов число градусов близко к 0, а чем сильнее степень сколиоза, тем дальше это число от 0. Согласно методу В.Д.Чаклина, угол между параллельными прямыми считается равным 180 градусам, и потому у слабых сколиозов число градусов близко к 180, а чем сильнее сколиоз, тем дальше это число от 180.
Для нижнего участка измерения проводятся точно также.
Классификация степеней тяжести в соответствии с методикой Кобба:
- Сколиоз 1 степени. Боковое отклонение невелико (до 10 градусов). Степень скручивания тоже мала (скручивание определяется в виде отклонения остистых отростков от средней линии и асимметрии корней дужек).
- Сколиоз 2 степени. Первичная дуга искривления составляет 10-25 градусов. Скручивание выражено заметно. На рентгеновских снимках видна деформация тел позвонков в верхней части искривления. Из-за скручивания позвоночника можно клинически определить мышечный валик.
- Сколиоз 3 степени. Первичная дуга искривления составляет 25-40 градусов. Деформация выражена еще ярче, имеется большой реберный горб, сильная деформация грудной клетки. Рентгенограмма показывает, что в верхней части искривления и прилегающих зонах есть позвонки клиновидной формы.
- Сколиоз 4 степени. Угол основного искривления составляет 40-90 градусов. Тяжелое обезображивание туловища. Задний и передний реберный горб, деформация таза и грудной клетки, кифосколиоз грудного отдела, обезыствествление связочного аппарата. Рентгенограммы показывают сильную клиновидную деформацию тел грудных позвонков.
Типы искривления позвоночника при сколиозе
Верхнегрудной (шейно-грудной) сколиоз
Это довольно редкая форма сколиоза, при которой образуется короткая дуга первичного искривления и длинная и пологая вторичная дуга. Затрагивает шейный отдел позвоночника, и иногда даже лицевые кости. Могут обнаруживаться кривая шея, асимметрия глаз, косой нос и так далее. Деформация верхней части грудной клетки и надплечья. Исправляется с трудом, особенно если процесс оказался запущенным, и лечение начато поздно.
Грудной сколиоз
При этом типе сколиоза искривление захватывает 6-7 позвонков. Выражены деформации позвоночника и грудной клетки, часто с образованием большого мышечного горба. Кроме крутой первичной дуги, образуются две вторичные дуги — выше и ниже основного искривления. Из-за скручивания плоскость таза не совпадает с плоскостью грудной клетки. На выпуклой стороне оттопыривается лопатка, на вогнутой — уплощается грудная клетка. Грудные сколиозы проявляются в среднем в 9-10 лет. Их нужно лечить в раннем возрасте, поскольку после окончательного формирования позвоночного столба лечение становится трудной или даже невозможной задачей.
Комбинированный сколиоз
Для этого типа характерно одновременное проявление обеих дуг — грудной и поясничной, то есть искривление позвоночника приобретает вид буквы S. Он встречается чаще у девочек, причем в грудной части обычно искривление идет в правую сторону, а в поясничной зоне — в левую. Лечится с трудом, в запущенном случае практически не лечится.
Грудопоясничный сколиоз
Характерно выпячивание гребня позвоночной кости на стороне вогнутости искривления. Также встречается чаще у девочек. Обычный возраст выявления — 9-10 лет. Лечится хорошо, особенно на ранней стадии.
Поясничный сколиоз
Затрагиваются обычно пять позвонков. При наклоне туловища заметно скручивание — в виде мышечного валика. Реберный горб отсутствует. Деформация грудной клетки слабая. Внутренние органы затрагиваются мало. Сколиоз этого типа не склонен к прогрессированию. Поэтому и течение его относительно благоприятное, и лечится сравнительно легко.
Подготовила врач-рентгенолог Ксензова А.Ф.
С целью оптимизации двигательной реабилитации пациентов в центре проводится комплексная физическая реабилитация, включающая роботизированную механотерапию.
Роботизированный комплекс «Локомат» применяется для восстановления (становления) навыков ходьбы, улучшения повседневной двигательной активности у пациентов с двигательным дефицитом.
Показанием к реабилитации на роботизированной системе являются: детский церебральный паралич, вялые параличи различной этиологии, последствия черепно-мозговых и спинальных травм, нервно-мышечные заболевания, последствия инсультов.
Противопоказания делятся на абсолютные и относительные. К абсолютным относятся: острые воспалительные заболевания, выраженный болевой синдром во время движения, задержка психического развития тяжелой степени, гиперкинетический синдром тяжелой степени, эпилепсия с некупированными приступами. К относительным противопоказаниям – спастичность мышц и контрактуры в нижних конечностях, гиперкинетический синдром средней степени, задержка психического развития средней степени, эпилепсия с редкими приступами.
В центре проводится комплексная реабилитация с применением роботизированной механотерапии по нескольким схемам:
- после нейрохирургических и ортопедических вмешательств (дорзальная селективная ризотомия, невротомия, теномиотомии, устранение контрактур, операции на тазобедренных суставах и стопах и др.).
- после ботулинотерапии.
- в рамках консервативной терапии.
Пациенты с I, II, III уровнем функционирования по шкале глобальных моторных функций получают данную терапию. Курс составляет 10-12 процедур, продолжительность от 10-15 до 40 минут. Скорость движения подбирается индивидуально от 0,5 до 2,0 км/ч. После оперативных вмешательств она составляет от 0,5 до 1,3 км/ч, в отсроченный послеоперационный период (через 3-6 месяцев) роботизированные тренировки становятся более интенсивными, увеличивается скорость ходьбы, пройденные расстояния. Во всех случаях проводиться разгрузка веса пациента на 50-30% от массы тела.
Преимущества роботизированной терапии:
- локомоторная терапия позволяет ускорить процесс восстановления (освоения) навыков стояния и ходьбы;
- улучшается динамическая и постуральная стабильность пациента в вертикальном положении;
- благодаря многократности повторений и БОС, формируется стереотип ходьбы, ритм шага;
- занятие на комплексе вызывает у ребенка мощный положительный психоэмоциональный всплеск, повышает мотивацию к самостоятельной ходьбе.
Реабилитационная система Tyrostation – это специальный стол с изменяемой высотой и отсеками для хранения тренажеров Tymo и Pablo.
Модули для реабилитации Pablo и Tymo позволяют проводить как силовой контроль, так и анализ диапазона движений. Настраиваемая степень сложности обеспечивает возможность персонализированной настройки терапии для каждого пациента.
Специально разработанные модули терапии и интерактивные игры мотивируют пациентов на выполнение необходимых задач, а также повышают внимание пациента и прогресс терапии благодаря аудио-визуальной и тактильной обратной связи.
Возможности реабилитационного модуля Tymo (стабилоплатформа):
- статический и динамический режимы применения: Tymo может использоваться в статичном режиме с помощью мягкой подкладки и в качестве платформы для движения в различных плоскостях пространства;
- многофункциональность: предустановленные программы могут быть дополнены врачом;
- применение в режиме поддержки: позволяет проводить терапию верхних конечностей;
- применение в режиме сидя: позволяет проводить функциональные тренировки сидя на платформе или стоя;
- применение в режиме стоя: проведение оценки и функциональной терапии нижних конечностей.
Эти функции используются при проведении оценочных программ и курсов терапии. С помощью этого подхода производится персонализированная оценка и терапия дисфункций пациента. Система документирует результаты в базе данных и позволяет проводить мониторинг прогресса терапии в режиме реального времени.
Pablo (Пабло) – это тренажёр для коррекции нарушений крупной и мелкой моторики мышц верхней конечности. Данный аппарат позволяет производить как оценку функциональных возможностей верхней конечности в начале и процессе лечения, так и осуществлять тренировки при помощи интерактивных программ. Основное направление использования Pablo – нейрологическая реабилитация дистальной верхней конечности. Cистемa может использоваться для тренировки мелкой моторики кисти (цилиндрический захват, сжатие и разжатие кисти, межпальцевые и щипковые захваты) с использованием БОС и игровых приложений.
Подготовила врач-педиатр Красильникова К.П.
Дефект межжелудочковой перегородки (ДМЖП) — врождённый порок сердца, характеризующийся наличием дефекта между правым и левым желудочками сердца. Встречается наиболее часто, причём как в изолированном виде, так и в составе многих других пороков сердца. Одинаково часто встречается как у мальчиков, так и у девочек.
Классификация
В межжелудочковой перегородке выделяют 3 отдела: верхняя часть — мембранозная, прилегает к центральному фиброзному телу, средняя часть — мышечная, и нижняя — трабекулярная. Соответственно этим отделам называют и дефекты межжелудочковой перегородки, однако большинство из них имеют перимембранозную локализацию (до 80 %). На долю мышечных ДМЖП приходится 20 %.
По размерам дефекты подразделяют на большие, средние и малые. Для правильной оценки величины дефекта его размер надо сравнивать с диаметром аорты. Мелкие дефекты размером 1-2 мм, расположенные в мышечной части межжелудочковой перегородки, называются болезнью Толочинова-Роже. Вследствие хорошей аускультативной картины и отсутствия гемодинамических нарушений для их характеристики уместно выражение: «много шума из ничего». Отдельно выделяют множественные большие дефекты межжелудочковой перегородки, по типу «швейцарского сыра», имеющие неблагоприятное прогностическое значение.
Гемодинамика
Внутрисердечные гемодинамические нарушения при ДМЖП начинают формироваться спустя некоторое время после рождения, как правило, на 3—5 сутки жизни. В раннем неонатальном периоде шум в сердце может отсутствовать вследствие одинакового давления в правом и левом желудочках из-за так называемой неонатальной легочной гипертензии. Постепенное падение давления в системе легочной артерии и в правом желудочке создаёт разность давлений между желудочками, вследствие чего появляется сброс крови слева направо. Дополнительный объём крови, поступающий в правый желудочек и легочную артерию, приводит к переполнению сосудов малого круга кровообращения, где развивается легочная гипертензия.
Выделяют три стадии легочной гипертензии по В. И. Бураковскому.
Застой крови (гиперволемическая стадия легочной гипертензии) может приводить к отёку легких, частому присоединению инфекции, развитию пневмоний, манифестирующих в ранние сроки жизни, имеющих тяжелое течение и плохо поддающихся лечению. Если с гиперволемией не удается справиться консервативными методами, в таких случаях проводят паллиативную операцию — сужение легочной артерии по Мюллеру. Однако повышенная нагрузка, падающая при этом на правый желудочек, диктует в дальнейшем (спустя 3—6 месяцев) необходимость проведения радикальной операции.
При естественном течении порока со временем в сосудах малого круга кровообращения срабатывает рефлекс Китаева (спазмирование в ответ на перерастяжение), что приводит к развитию переходной стадии лёгочной гипертензии. В этот период ребёнок перестает болеть, становится более активным, начинает прибавлять в весе. Стабильное состояние пациента в эту фазу является лучшим периодом для проведения радикальной операции.
В дальнейшем, если хирургическая коррекция ВПС не проводится, начинают формироваться процессы склерозирования сосудов легких (высокая легочная гипертензия — синдром Эйзенменгера). Этот патологический процесс не имеет обратного развития и приводит к значительному повышению давления в легочной артерии (иногда до 100—120 мм рт. ст.).
Аускультативно можно выслушать резко выраженный акцент II тона над легочной артерией («металлический» оттенок). Систолический шум становится слабо-интенсивным, а в некоторых случаях может совсем отсутствовать. На этом фоне можно зафиксировать появление нового диастолического шума, обусловленного недостаточностью клапанов лёгочной артерии (шум Грехема-Стилла). В клинической картине заболевания отмечается множество патологических признаков: сердечный «горб», расширение границ относительной сердечной тупости, больше вправо. Над легкими выслушиваются участки ослабленного и жесткого дыхания, могут встречаться свистящие хрипы. Самым характерным признаком синдрома Эйзенменгера является постепенное нарастание цианоза. Наличие у пациента третьей стадии легочной гипертензии может стать основным мотивом отказа кардиохирургов от проведения операции.
Клиническая картина
Клиническая картина при ДМЖП заключается в симптомокомплексе сердечной недостаточности, развивающейся, как правило, на 1-3 месяцах жизни (в зависимости от размеров дефекта). Кроме признаков сердечной недостаточности ДМЖП может манифестировать ранними и тяжелыми пневмониями. При осмотре ребёнка можно выявить тахикардию и одышку, расширение границ относительной сердечной тупости, смещение верхушечного толчка вниз и влево. В ряде случаев определяется симптом «кошачьего мурлыканья». Систолический шум, как правило, интенсивный, выслушивается над всей областью сердца, хорошо проводится на правую сторону грудной клетки и на спину с максимальной интенсивностью в IV межреберье слева от грудины. При пальпации живота определяется гепатомегалия и спленомегалия. Изменения периферической пульсации не характерны. У детей с ДМЖП как правило быстро развивается гипертрофия.
Диагностика
Диагностика любого порока сердца складывается из рентгенологического исследования органов грудной полости, электрокардиографии и двухмерной допплерэхокардиографии.
При рентгенологическом исследовании органов грудной клетки описывают форму сердца и состояние легочного рисунка, определяют размер кардио-торакального индекса (КТИ). Все эти показатели имеют свои особенности при разных степенях лёгочной гипертензии. В первой, гиперволемической стадии, выявляется сглаженность талии и погруженность верхушки сердца в диафрагму, увеличение КТИ. Со стороны легочного рисунка отмечается его усиление, нечеткость, размытость. Крайней степенью гиперволемии в лёгких является отёк лёгких. В переходной стадии лёгочной гипертензии отмечается нормализация лёгочного рисунка, некоторая стабилизация размеров КТИ. Для склеротической стадии лёгочной гипертензии характерно значительное увеличение размеров сердца, причем в основном за счёт правых отделов, увеличение правого предсердия (формирование прямого атрио-вазального угла), выбухание дуги лёгочной артерии (индекс Мура более 50 %), приподнятость верхушки сердца, которая образует с диафрагмой острый угол. Со стороны лёгочного рисунка часто описывается симптом «обрубленного дерева»: яркие, чёткие, увеличенные корни, на фоне которых лёгочный рисунок прослеживается только до определённого уровня. На периферии имеет место признаки эмфиземы. Грудная клетка имеет вздутую форму, ход ребер горизонтальный, диафрагма уплощена, стоит низко.
ЭКГ имеет свои закономерности, тесно связанные с фазой течения ВПС и степенью лёгочной гипертензии. Сначала выявляются признаки перегрузки левого желудочка — повышение его активности, затем развитие его гипертрофии. С течением времени присоединяются признаки перегрузки и гипертрофии правых отделов сердца — как предсердия, так и желудочка, — это свидетельствует о высокой лёгочной гипертензии. Электрическая ось сердца всегда отклонена вправо. Могут встречаться нарушения проводимости — от признаков неполной блокады правой ножки пучка Гиса до полной атрио-вентрикулярной блокады.
При допплер-ЭхоКГ уточняется место расположения дефекта, его размер, определяется давление в правом желудочке и лёгочной артерии. В первой стадии лёгочной гипертензии давление в ПЖ не превышает 30 мм.рт.ст., во второй стадии — от 30 до 70 мм.рт.ст., в третьей — более 70 мм.рт.ст.
Лечение
Лечение данного порока подразумевает консервативную терапию сердечной недостаточности и хирургическую коррекцию порока сердца. Консервативное лечение складывается из препаратов инотропной поддержки (симпатомиметики, сердечные гликозиды), мочегонных препаратов, кардиотрофиков. В случаях высокой легочной гипертензии назначаются ингибиторы ангиотензинпревращающего фермента — капотен или каптоприл.
Оперативные вмешательства подразделяются на паллиативные операции (в случае ДМЖП — операция суживания лёгочной артерии по Мюллеру) и радикальную коррекцию порока — пластика дефекта межжелудочковой перегородки заплатой из листков перикарда в условиях искусственного кровообращения, кардиоплегии и гипотермии.
Информацию подготовила врач УЗИ Кузнецова Н.И.
Источник информации:
Белоконь Н.А., Подзолков В.П. «Врожденные пороки сердца»
М.К.Рыбакова, В.В.Митьков «Эхокардиография»
Неправильное положение головы вызвано укорочением и функциональной неполноценностью одной из грудино-ключично-сосцевидных мышц в результате её врождённого недоразвития или действия интранатальных повреждающих факторов, сопровождающееся вторичными изменениями шейного отдела позвоночника и костей черепа. По частоте встречающихся случаев заболевания занимает 2-3 место после врождённого вывиха бедра и врождённой косолапости.
Клиническая картина при врожденной мышечной кривошеи следующая: голова наклонена в сторону пораженной мышцы и повёрнута в противоположную сторону с одновременным отклонением назад. Надплечье и лопатка при выражённой кривошее на стороне поражения выше, затылок со здоровой стороны нередко скошен. Кь вторичным изменениям при ВМК относится асимметрия лица. При средней и тяжелой степенях ВМК (II-III) может отмечаться отставание ребёнка в психомоторном развитии. С ростом детей, перенесших ВМК, отмечаются сглаженность шейного лордоза, формирование патологического кифоза, отставание в росте тел позвонков за счёт травмы ростковых зон, явления остеохондроза. При декомпенсированных стадиях ВМК развивается сколиотическая болезнь в грудном отделе позвоночника и более медленное восстановление нарушений в шейном отделе.
При комплексном консервативном и оперативном лечении детей с ВМК первостепенное место занимает ЛФК, используемая с первых дней установки диагноза, задачи которой выражаются в улучшении трофики пораженной и здоровой грудино-ключично-сосцевидных мышц; уравновешивание мышечного тонуса за счёт устранения контрактуры пораженной и укрепления мышцы на здоровой стороне; нормализация объема движений в шейном отделе позвоночника; профилактика вторичных изменений (асимметрия лица, шеи, искривления позвоночника); предупреждение или устранение отставания в психомоторном развитии; повышение неспецифической сопротивляемости организма.
Для решения поставленных задач используются: лечение положением, массаж, физические упражнения, упражнения в воде.
При лёгких формах ВМК рекомендуется использовать ортопедические аппараты, разработанные В.Б. Мироедовым (1996), основанные на принципе дистракции мягких тканей на стороне поражения. При невозможносги коррекции кривошеи консервативным методом прибегают к операции. Выделяют пред- и послеоперационный периоды, на поликлиническом этапе реабилитации занятия продолжаются до 9-12 месяцев. Главная задача ЛФК — полное восстановление функции оперированной мышцы. С этой целью используются различные движения головой с сопротивлением и отягощением в различных положениях. Продолжается коррекция осанки (особенно в грудном отделе).
До 14 лет дети с ВМК находятся на диспансерном учете.
Подготовила врачфизической и реабилитационной медицины Сергеева Ю.В.
Физиотерапия – лечение, которое проводится путем воздействия на организм природных и искусственно созданных факторов: магнитных полей, тепла, света, ультразвука, ультрафиолетового излучения, токов различной частоты и др. Современные методики более безопасны, чем лекарственные препараты. Это обусловлено тем, что они направлены на активацию собственных защитных и восстанавливающих механизмов организма. Благодаря этому физиотерапия может быть рекомендована как взрослым, так и детям; она может быть основным или дополнительным элементом лечебного курса.
Лечебный эффект различных методик основан на запуске в организме (в тканях, органах и целых системах) определенных процессов, направленных на самостоятельное выздоровление. Каждому пациенту назначается индивидуальный курс. Он может быть нацелен не только на лечение, но и на реабилитацию или профилактику.
При подборе подходящих методик учитываются:
- Показания и противопоказания
- Индивидуальные особенности пациента
- Основные и сопутствующие заболевания
Физиотерапия для детей с использованием естественных факторов
В рамках терапии, профилактики и реабилитации проводятся:
- Водные процедуры
- Грязелечение
- Теплолечение
- Массаж
Пациентам также назначают солнечные и воздушные ванны, дыхательную и двигательную гимнастику.
Аппаратная физиотерапия для детей
Выделяют 3 основных направления аппаратных методов:
- Электротерапия. Воздействие оказывается постоянными токами низкого напряжения, электрическим полем или переменными токами
- Магнитотерапия. Такое лечение проводится путем низко- и высокочастотного воздействия
- Фототерапия. Лечение проводится с использованием видимого и ультрафиолетового излучения
К самым популярным методикам относят:
- Низкочастотную импульсную электротерапию. Она оказывает мощное воздействие, стимулирует нервы и мышцы. Это обеспечивает восстановление поврежденных нервных волокон, улучшает состояние мышечного аппарата и даже способствует общему похудению. Процедуры улучшают и обменные процессы, что положительно сказывается на работе всех органов и систем
- УВЧ. Такое воздействие обеспечивается электромагнитным полем ультравысокой частоты. Терапия положительно сказывается на состоянии всех тканей организма, так как осуществляется их бережный, но эффективный прогрев. В результате процедур улучшается кровоснабжение, достигаются обезболивающий, противоотечный, противовоспалительный и спазмолитический эффекты. Также УВЧ положительно сказывается на работе иммунной системы. После курса такой физиотерапии иммунитет начинает активно бороться с опасными микроорганизмами. УВЧ рекомендовано при частых заболеваниях органов дыхания, острых кожных воспалениях, патологиях периферической нервной системы
- Инфракрасное светолечение. В ходе процедуры воздействие производится на глубине до 2-3 см. Благодаря этому стимулируется самостоятельное восстановление тканей, устраняются боли, снимаются спазмы, улучшаются обменные процессы. Фототерапия рекомендована при пневмонии и бронхите, неврите, артрите, кариесе и рахите, повышенной проницаемости сосудов
- Дарсонваль. Данная процедура заключается в воздействии на организм токов переменной высокой частоты и напряжения. Применяется такое лечение для устранения проблем местного характера. Обычно Дарсонваль назначается при стоматологических заболеваниях, патологиях ЛОР-органов, дерматозах
Сегодня активно применяются и многие другие методики. Все они дают выраженный эффект в конкретных случаях. При необходимости методики комбинируются между собой или сочетаются с фармакологическим лечением.
Подготовила врач физической и реабилитационной медицины Сергеева Ю.В
Эффект контралатеральных нейромышечных тренировок на статический и динамический баланс, функцию колена и уровень боли у атлетов, перенесших реконструкцию передней крестообразной связки.
Передняя крестообразная связка (ПКС) обеспечивает не только механическую стабильность колена, но и способствует его нейромышечной стабильности (Nagai, 2013), интегрируя проприоцептивные сигналы от различных механорецепторов, локализованных в ее структуре, в сенсомоторную систему (Ordahan, 2015). Эти механорецепторы могут определять изменения мышечного напряжения, скорости/ускорения, направления движения и положения коленного сустава (Furlanetto, 2016).
В различных исследованиях (например, в работах Cooper (2005) и Nagelli (2021)) оценивались различные методы реабилитации, ориентированные на минимизацию нервно-мышечного дефицита и ускорение восстановления функции равновесия после реконструкции ПКС. Обычно послеоперационная реабилитация начинается с пассивного увеличения амплитуды движений и осевой нагрузки на оперированную ногу. В течение первой недели после операции также назначаются упражнения для активации мышц бедра. Постепенно силовая нагрузка увеличивается и в программу тренировок включаются упражнения на улучшение нейромышечного контроля, включающие динамическую стабилизацию и упражнения на «контролируемую нестабильность».
Несмотря на усилия по улучшению программ нервно-мышечных тренировок, все исследования, в основном, были нацелены на оперированное колено, и мало что известно об эффективности «контралатеральных тренировок» (при полном бездействии или низкой активности мышц оперированной ноги) на ранней стадии реабилитации после реконструкции ПКС. Контралатеральная тренировка, также известная как кросс-тренинг или перекрестное обучение, представляет собой нейронную адаптацию, которая основана на работе с одной конечностью с целью положительного воздействия на другую конечность (Farthing, 2009; Kim, 2011).
Точные механизмы перекрестной тренировки еще не определены, но предполагается, что анатомическая и нейронная связь между двумя полушариями мозга играет важную роль в передаче информации от противоположных частей тела Carroll, 1985; Eliassen1999). Теоретически, выполнение упражнений для одной конечности может вызвать функциональную перестройку между различными частями мозга и первичной моторной корой полушарий. Соединения мозолистого тела между двигательной областью и префронтальной корой в полушариях мозга являются местами, где происходит адаптация. Также этому улучшению могут способствовать спинномозговые рефлекторные пути, включающие реципрокное торможение (Lepley, 2018; Papandreou, 2009).
В своем исследовании Karimijashni (2023) изучил влияние прогрессивных (с открытыми и закрытыми глазами, на стабильной и нестабильной поверхности, с сопутствующими упражнениями на верхние конечности, с метательными упражнениями) контралатеральных нервно-мышечных тренировок, выполняемых на здоровой ноге, на состояние оперированной ноги. Тренировки начинались с первой недели и продолжались в течение 8 недель (испытуемые занимались 4 раза в неделю) в дополнение к обычной программе физической терапии в группе вмешательства (n=15 мужчин-спортсменов) по сравнению с контрольной группой с обычной программой физической терапии (n=15 мужчин-спортсменов).
Сравнение групп показало, что нейромышечные упражнения для контралатерального коленного сустава значительно увеличили расстояние дотягивания в тесте на баланс «Движение по траектории звезды» в направлении вперед, назад, задне-медиально, задне-латерально. Уменьшилось количество ошибок в 4 позициях по Системе оценки ошибок баланса (BESS), включая стойку на одной ноге на твердой и мягкой поверхности, и тандемную стойку на твердой и мягкой поверхности. Также увеличилось время стояния в тесте «стойка аиста», уменьшилась интенсивность боли в колене.
Результаты исследования показали, что выполнение перекрестных упражнений на баланс в течение 8 недель улучшает динамический и статический баланс в оперированной ноге на ранних стадиях реабилитации после реконструкции ПКС, что особенно ценно, когда тренировка баланса на оперированной ноге может быть слишком преждевременной или не совсем уместной. Таким образом, результаты данного исследования могут быть потенциально ценными для пересмотра текущих протоколов реабилитации.
Подготовил инструктор-методист ЛФК Бредихин Н.С.
Аудиограмма — график слуховых ощущений пациента. Она помогает диагностировать нарушения слуха. На аудиограмме две оси: горизонтальная — частота (количество звуковых колебаний в секунду, выражается в герцах) и вертикальная — интенсивность звука (относительная величина, выражается в децибелах). На аудиограмме отмечается костная проводимость (звук, который в виде вибраций доходит до внутреннего уха через кости черепа) и воздушная проводимость (звук, который достигает внутреннего уха обычным путём — через наружное и среднее ухо).
При аудиометрии пациенту подают сигнал разной частоты и интенсивности и отмечают точками величину минимального звука, который слышат пациент. Каждая точка показывает минимальную интенсивность звука, при которой пациент слышит на конкретной частоте. Соединив точки, получаем график, а точнее, два — один для костного звукопроведения, другой — для воздушного.
Норма слуха — когда графики лежат в диапазоне от 0 до 25 дБ. Разница между графиком костного и воздушного звукопроведения называется костно-воздушным интервалом. Если график костного звукопроведения в норме, а график воздушного лежит ниже нормы (присутстувет костно-воздушный интервал), это показатель кондуктивной тугоухости. Если график костного звукопроведения повторяет график воздушного, и оба лежат ниже нормального диапазона, это говорит о сенсоневральной тугоухости. Если чётко определяется костно-воздушный интервал, и при этом оба графика показывают нарушения, значит, тугоухость смешанная.
Основные понятия аудиометрии
Чтобы понять, как расшифровать аудиограмму, сначала остановимся на некоторых терминах и самой методике аудиометрии.
У звука две основные физические характеристики: интенсивность и частота.
Интенсивность звука определяется силой звукового давления, которое у человека весьма вариабельно. Поэтому для удобства принято пользоваться относительными величинами, такими как децибелы (дБ) — это десятичная шкала логарифмов.
Частоту тона оценивают количеством звуковых колебаний в секунду и выражают в герцах (Гц). Условно диапазон звуковых частот делят на низкие — ниже 500Гц, средние (речевые) 500−4000Гц и высокие — 4000Гц и выше.
Аудиометрия — это измерение остроты слуха. Эта методика субъективна и требует обратной связи с пациентом. Исследующий (тот, кто проводит исследование) при помощи аудиометра подаёт сигнал, а исследуемый (слух которого исследуют) даёт знать, слышит он этот звук или нет. Чаще всего для этого он нажимает на кнопку, реже — поднимает руку или кивает, а дети складывают игрушки в корзину.
Существуют различные виды аудиометрии: тональная пороговая, надпороговая и речевая. На практике наиболее часто применяется тональная пороговая аудиометрия, которая определяет минимальный порог слуха (самый тихий звук, который слышит человек, измеряемый в децибелах (дБ)) на различных частотах (как правило, в диапазоне 125Гц — 8000 Гц, реже до 12 500 и даже до 20 000 Гц). Эти данные отмечаются на специальном бланке.
Аудиограмма — график слуховых ощущений пациента. Эти ощущения могут зависеть как от самого человека, его общего состояния, артериального и внутричерепного давления, настроения и т. д., так и от внешних факторов — атмосферных явлений, шума в помещении, отвлекающих моментов и т. д.
Как строится график аудиограммы
Для каждого уха раздельно измеряют воздушную проводимость (через наушники) и костную проводимость (через костный вибратор, который располагают позади уха).
Воздушная проводимость — это непосредственно слух пациента, а костная проводимость — слух человека, исключая звукопроводящую систему (наружное и среднее ухо), её ещё называют запасом улитки (внутреннего уха).
Костная проводимость обусловлена тем, что кости черепа улавливают звуковые вибрации, которые поступают ко внутреннему уху. Таким образом, если имеется препятствие в наружном и среднем ухе (любые патологические состояния), то звуковая волна достигает улитки благодаря костной проводимости.
Бланк аудиограммы
На бланке аудиограммы чаще всего правое и левое ухо изображены раздельно и подписаны (чаще всего правое ухо слева, а левое ухо справа), как на рисунках 2 и 3. Иногда оба уха отмечаются на одномбланке, их различают либо цветом (правое ухо всегда красным, а левое — синим), либо символами (правое кругом или квадратом (0---0---0), а левое — крестом (х---х---х)). Воздушную проводимость всегда отмечают сплошной линией, а костную — прерывистой.
По вертикали отмечают уровень слуха (интенсивность стимула) в децибелах (дБ) с шагом в 5 или 10 дБ, сверху вниз, начиная от −5 или −10, а заканчивая 100 дБ, реже 110 дБ, 120 дБ. По горизонтали отмечаются частоты, слева направо, начиная от 125 Гц, далее 250 Гц, 500Гц, 1000Гц (1кГц), 2000Гц (2кГц), 4000Гц (4кГц), 6000Гц (6кГц), 8000Гц (8кГц) и т. д., могут быть некоторые вариации. На каждой частоте отмечается уровень слуха в децибелах, потом точки соединяют, получается график. Чем выше график, тем лучше слух.
Как расшифровать аудиограмму
При обследовании больного в первую очередь необходимо определить топику (уровень) поражения и степень слуховых нарушений. Правильно выполненная аудиометрия даёт ответ на оба этих вопроса.
Патология слуха может быть на уровне проведения звуковой волны (за этот механизм отвечает наружное и среднее ухо), такую тугоухость называют проводниковой или кондуктивной; на уровне внутреннего уха (рецепторный аппарат улитки), данная тугоухость является сенсоневральной (нейросенсорной), иногда бывает сочетанное поражение, такую тугоухость называют смешанной. Крайне редко встречаются нарушения на уровне слуховых проводящих путей и коры головного мозга, тогда говорят о ретрокохлеарной тугоухости.
Аудиограммы (графики) могут быть восходящими (чаще всего при кондуктивной тугоухости), нисходящими (чаще при сенсоневральной тугоухости), горизонтальными (плоскими), а также иной конфигурации. Пространство между графиком костной проводимости и графиком воздушной — это костно-воздушный интервал. По нему определяют, с каким видом тугоухости мы имеем дело: нейросенсорной, кондуктивной или смешанной.
Если график аудиограммы лежит в диапазоне от 0 до 25 дБ по всем исследуемым частотам, то считается, что у человека нормальный слух. Если график аудиограммы спускается ниже, то это патология. Тяжесть патологии определяется степенью тугоухости. Существуют различные расчёты степени тугоухости. Однако наиболее широкое распространение получила международная классификация тугоухости, по которой рассчитывается среднеарифметическая потеря слуха на 4 основных частотах (наиболее важных для восприятия речи): 500 Гц, 1000 Гц, 2000 Гц и 4000 Гц.
1 степень тугоухости — нарушение в пределах 26−40 дБ,
2 степень — нарушение в диапазоне 41−55 дБ,
3 степень — нарушение 56−70 дБ,
4 степень — 71−90 дБ и свыше 91 дБ — зона глухоты.
1 степень определяется как лёгкая, 2 — среднетяжёлая, 3 и 4 — тяжёлая, а глухота — крайне тяжёлая.
Если костное звукопроведение в норме (0−25дБ), а воздушное проведение нарушено, это показатель кондуктивной тугоухости. В случаях, когда нарушено и костное, и воздушное звукопроведение, но есть костно-воздушный интервал, у пациента смешанный тип тугоухости (нарушения и в среднем и во внутреннем ухе). Если костное звукопроведение повторяет воздушное, то это сенсоневральная тугоухость. Однако при определении костной звукопроводимости необходимо помнить, что низкие частоты (125Гц, 250Гц) дают эффект вибрации и исследуемый может принимать это ощущение за слуховое. Поэтому нужно критически относиться к костно-воздушному интервалу на данных частотах, особенно при тяжёлых степенях тугоухости (3−4 степени и глухоте).
Кондуктивная тугоухость редко бывает тяжелой степени, чаще 1−2 степень тугоухости. Исключения составляют хронические воспалительные заболевания среднего уха, после хирургических вмешательствах на среднем ухе и т. д., врожденные аномалии развития наружного и среднего уха (микроотии, атрезии наружных слуховых проходов и т. д.), а также при отосклерозе.
Рис.1 — пример нормальной аудиограммы: воздушная и костная проводимость в пределах 25 дБ во всём диапазоне исследуемых частот с обеих сторон.
На рисунках 2 и 3 представлены типичные примеры кондуктивной тугоухости: костное звукопроведение в пределах нормы (0−25дБ), а воздушное нарушено, имеется костно-воздушный интервал
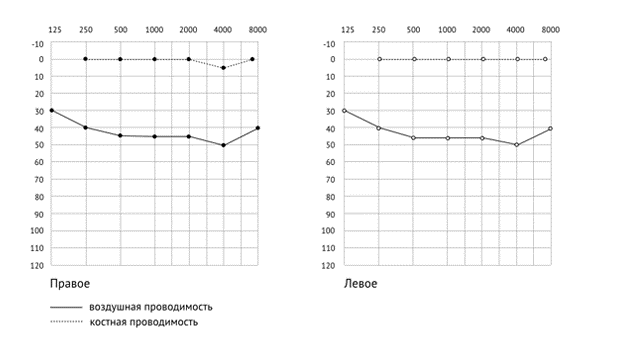
Рис. 2. Аудиограмма пациента с двусторонней кондуктивной тугоухостью.
Чтобы рассчитать степень тугоухости, складываем 4 величины — интенсивность звука на 500, 1000, 2000 и 4000 Гц и делим на 4, чтобы получить среднее арифметическое. Получаем справа: на 500Гц — 40дБ, 1000Гц — 40 дБ, 2000Гц — 40 дБ, 4000Гц — 45дБ, в сумме — 165 дБ. Делим на 4, равно 41,25 дБ. Согласно международной классификации, это 2 степень тугоухости. Определяем тугоухость слева: 500Гц — 40дБ, 1000Гц —— 40 дБ, 2000Гц — 40 дБ, 4000Гц — 30дБ = 150, разделив на 4, получаем 37,5 дБ, что соответствует 1 степени тугоухости. По данной аудиограмме можно сделать следующее заключение: двусторонняя кондуктивная тугоухость справа 2 степени, слева 1 степени.
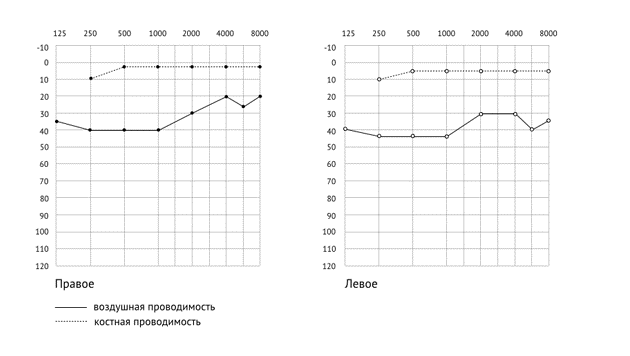
Рис. 3. Аудиограмма пациента с двусторонней кондуктивной тугоухостью.
Аналогичную операцию выполняем для рисунка 3. Степень тугоухости справа: 40+40+30+20=130; 130:4=32,5, т. е. 1 степень тугоухости. Слева соответственно: 45+45+40+20=150; 150:4=37,5, что также является 1 степенью. Таким образом, можно сделать следующее заключение: двусторонняя кондуктивная тугоухость 1 степени.
Примерами сенсоневральной тугоухости являются рисунки 4 и 5. На них видно, что костная проводимость повторяет воздушную. При этом на рисунке 4 слух на правом ухе в норме (в пределах 25 дБ), а слева имеется сенсоневральная тугоухость, с преимущественным поражением высоких частот.
Рис. 4. Аудиограмма пациента с сенсоневральной тугоухостью слева, правое ухо в норме.
Степень тугоухости рассчитываем для левого уха: 20+30+40+55=145; 145:4=36,25, что соответствует 1 степени тугоухости. Заключение: левосторонняя сенсоневральная тугоухость 1 степени.
Рис. 5. Аудиограмма пациента с двусторонней сенсоневральной тугоухостью.
Для данной аудиограммы показательным является отсутствие костного проведения слева. Это объясняется ограниченностью приборов (максимальная интенсивность костного вибратора 45−70 дБ). Рассчитываем степень тугоухости: справа: 20+25+40+50=135; 135:4=33,75, что соответствует 1 степени тугоухости; слева — 90+90+95+100=375; 375:4=93,75, что соответствует глухоте. Заключение: двусторонняя сенсоневральная тугоухость справа 1 степени, слева глухота.
Аудиограмма при смешанной тугоухости отображена на рисунке 6.
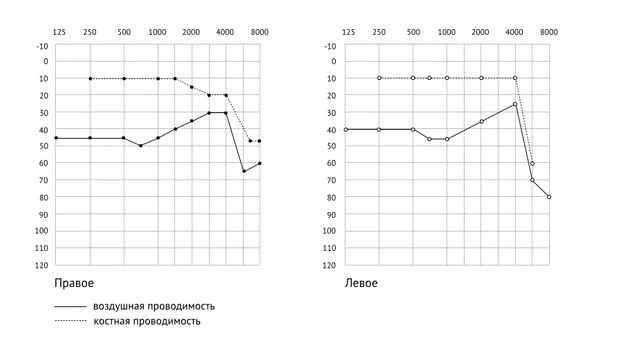
Рисунок 6. Имеются нарушения как воздушного, так и костного звукопроведения. Чётко определяется костно-воздушный интервал.
Степень тугоухости рассчитываем согласно международной классификации, которая составляет для правого уха среднеарифметическое значение 31,25дБ, а для левого — 36,25дБ, что соответствует 1 степени тугоухости. Заключение: двусторонняя тугоухость 1 степени по смешанному типу.
Материал подготовила врач-сурдолог-оториноларинголог Холина Ю.А.
Телесно-ориентированная терапия:
упражнения на снятие излишнего напряжения
Цель:
Предлагаемые упражнения позволяют прочувствовать свое тело, осознать степень его напряжения, гармонизируют психофизические функции.
Упражнение “Моечная машина”
Все участники становятся в две шеренги лицом дуг к другу. Первый человек становится «машиной”, последний - “сушилкой”. “Машина «проходит между шеренгами, все ее моют, поглаживают, бережно и аккуратно потирают. «Сушилка” должна его высушить — обнять. Прошедший “мойку” становятся “сушилкой”, с начала шеренги идет следующая “машина”.
Упражнение “Растем”
Участники находятся в круге. Исходное положение — сидя на корточках, голову нагнуть к коленям, обхватив их руками.
Инструкция ведущего: Представьте, что вы маленький росток, только что показавшийся из земли. Вы растете, постепенно распрямляясь, раскрываясь и устремляясь вверх. Я буду помогать вам расти, считая до пяти. Постарайтесь равномерно распределить стадии роста.
Усложняя в будущем упражнение, ведущий может увеличить продолжительность роста до 10—20стадий. После выполнения упражнения полезно сразу же перейти к упражнению “Потянулись -сломались”.
Упражнение “Потянулись - сломались”
Исходное положение — стоя, руки и все тело устремлены вверх, пятки от пола не отрывать.
Инструкция ведущего: Тянемся, тянемся вверх, выше, выше,.. Мысленно отрываем пятки от пола, чтобы стать еще выше (реально пятки на полу)... А теперь наши кисти как бы сломались, безвольно повисли. Теперь руки сломались в локтях, в плечах, упали плечи, повисла голова, сломались в талии, подогнулись колени, упали на пол... Лежим расслабленно, безвольно, удобно... Прислушайтесь к себе. Осталось ли где-нибудь напряжение? Сбросили его!
Медитация
Цель: снятие эмоционального напряжения. Включить аудиомедитацию.
Использование медитативных техник приводит к формированию внутрипсихических барьеров, которые могут дезактивировать действия отрицательных раздражителей, способствует положительной перестройке и укреплению психических функций, связанных с эмоционально-волевой сферой человека. При выполнении медитации соблюдаются следующие правила: уединение; удобная, но не расслабляющая поза.
Упражнение “Концентрация на счете”
Инструкция преподавателя:
Мысленно медленно считайте от 1 до 10 и сосредоточьтесь на этом медленном счете. Если в какой-то момент мысли начнут рассеиваться и вы будете не в состоянии сосредоточиться на счете, начните считать сначала. Повторяйте счет в течение нескольких минут.
«Аутогенная тренировка»
(звучит релаксационная музыка)
Аутогенная тренировка (АТ)– это самовнушение в состоянии релаксации. Создателем этого метода является И. Шульц. Смысл аутогенной тренировки заключается в том, что при расслаблении поперечно – полосатой мускулатуры возникает особое состояние сознания, позволяющее путем самовнушения воздействовать на различные, в том числе непроизвольные, функции организма. Аутогенная тренировка способствует снижению эмоционального напряжения, чувства тревоги дискомфорта. Под влиянием АТ улучшается настроение, нормализуется сон, происходит активизация организма и личности.
С помощью АТ можно решать задачи укрепления воли, коррекции некоторых неадекватных форм поведения, мобилизации ресурсов человека, отдыха и восстановления сил за короткое время.
Инструкция.
1. Сделайте глубокий вдох, спокойный выдох, закройте глаза. Дышите легко, спокойно, свободно.
2. Вызываем ощущение тяжести. Мысленно повторяем:
«Я совершенно спокоен» (1 раз)
«Моя правая (левая) рука тяжелая» (3 раза), «Я спокоен» (1 раз)
«Я совершенно спокоен» (1 раз)
«Моя правая (левая) нога тяжелая» (3 раза), «Я спокоен» (1 раз)
«Я совершенно спокоен» (1 раз)
«Мое тело тяжелое» (3 раза), «Я спокоен» (1 раз)
3. Вызываем ощущение тепла. Мысленно повторяем:
«Я спокоен» (1 раз)
«Мое тело теплое» (3 раза),
«Моя правая (левая) рука теплая» (3 раза), «Я спокоен» (1 раз)
«Я спокоен» (1 раз)
«Моя правая (левая) нога теплая» (3 раза), «Я спокоен» (1 раз)
«Я спокоен» (1 раз)
«Мое тело теплое» (3 раза), «Я совершенно спокоен» (1 раз)
«Я спокоен» (1 раз)
«Обе руки теплые» (3 раза),
«Обе ноги теплые» (3 раза), «Моё тело теплое» (3 раза)
«Я совершенно спокоен» (1 раз)
4. Второе и третье упражнение объединяются одной формулой:
«Руки и ноги тяжелые и теплые» (3 раза), «Я спокоен» (1 раз),
«Мое тело тяжелое и теплое» (3 раза), «Я совершенно спокоен» (1 раз)
5. Регуляция дыхания.
«Я спокоен» (1 раз), «Мои руки и ноги теплые и тяжелые» (3 раза),
«Моё сердце бьётся спокойно» (3 раза),
«Я дышу спокойно, глубоко, свободно» (3 раза)
«Я совершенно спокоен» (1 раз).
6. Влияем на органы брюшной полости
«Я спокоен» (1 раз), «Мои руки и ноги теплые и тяжелые» (1 раз),
«Моё сердце бьётся спокойно» (1 раз),
«Я дышу спокойно, глубоко, свободно» (1 раз)
«Моё солнечное сплетение теплое, оно излучает тепло» (3 раза),
«Я спокоен» (1 раз)
7. Вызываем ощущение прохлады в области лба
«Я спокоен» (1 раз), «Мои руки и ноги теплые и тяжелые» (1 раз),
«Моё сердце бьётся спокойно» (1 раз),
«Я дышу спокойно, глубоко, свободно» (1 раз)
«Моё солнечное сплетение теплое, оно излучает тепло» (1 раз),
«Мой лоб прохладный и расслабленный» (3 раза),
«Я спокоен» (1 раз)
Всё тело отдыхает. Восстанавливаются силы, возрождается весь организм. Мобилизуются внутренние ресурсы. Ощущение глубокого покоя, полной отрешенности.
Просмотрите своё тело сверху – вниз. Все тело спокойно отдыхает. Нервная система восстанавливает силы. Теперь мысленно представьте окружающую Вас обстановку. Вспомните и осмотрите себя как бы сверху и все, что Вас окружает. Мысленно посмотрите вдаль. Вспомните свои предстоящие и текущие дела.
Сделайте дыхание более глубоким и энергичным. Слегка подвигайте стопами. Пошевелите пальцами ног. Почувствуйте, как исчезают последние остатки вялости и расслабленности. Ладони медленно сожмите в кулаки и расслабьте. Подвигайте сжатыми губами. Сделайте глубокий вдох и откройте глаза. Откройте глаза и улыбнитесь.
Упражнение «Чему Я научился».
Предлагается большой лист бумаги со следующими неоконченными предложениями:
Я научился...
Я узнал, что...
Я нашел подтверждение тому, что...
Я обнаружил, что...
Я был удивлен тем, что...
Мне нравится, что...
Я был разочарован тем, что...
Самым важным для меня было...
Мне сегодня...
Подготовила врач психиатр, психотерапевт Осмоловская Н.Е.
Сон давно считается мощным активатором эпилептиформной активности. Известно, что эпилептиформная активность отмечается преимущественно в I и II стадиях медленного сна. Рядом авторов отмечено, что медленноволновой сон избирательно облегчает возникновение генерализованных пароксизмов, а быстрый сон — локальных и особенно височного генеза.
Как известно, медленная и быстрая фазы сна соотносятся с деятельностью различных физиологических механизмов, а между регистрируемыми во время этих фаз сна электроэнцефалографическими феноменами и активностью коры и подкорковых образований мозга существует связь. Главной синхронизирующей системой, ответственной за фазу медленного сна, является таламо-кортикальная система. В организации быстрого сна, характеризующегося десинхронизирующими процессами, участвуют структуры ствола головного мозга, в основном варолиевого моста.
Кроме того, у детей раннего возраста целесообразнее осуществлять оценку биоэлектрической активности в состоянии сна не только потому, что в этот возрастной период запись во время бодрствования искажена двигательными и мышечными артефактами, но и в связи с ее недостаточной информативностью вследствие несформированности основного коркового ритма. В то время как, возрастная динамика биоэлектрической активности в состоянии сна идет значительно интенсивнее и уже в первые месяцы жизни у ребенка на электроэнцефалограмме сна наблюдаются все основные ритмы, свойственные в этом состоянии взрослому.
Необходимо отметить, что для идентификации фаз и стадий сна одновременно с ЭЭГ осуществляется регистрация электроокулограммы и электромиограммы.
Нормальный сон человека cocтoит из чередования серии циклов фаз медленного сна (non-REM-сон) и быстрого сна (REM-сон). Хотя у новорожденного доношенного ребенка можно идентифицировать и недифференцированный сон, когда невозможно четко отграничить фазы быстрого и медленного сна .
В фазу быстрого сна часто наблюдаются сосательные движения, отмечаются практически непрекращающиеся движения тела, улыбки, гримасы, легкий тремор, вокализация. Одновременно с фазовыми движениями глазных яблок отмечаются вспышки мышечных движений и нерегулярное дыхание. Фаза медленного сна характеризуется минимальной двигательной активностью.
Начало сна новорожденных детей знаменуется наступлением фазы быстрого сна, которая на ЭЭГ характеризуется низкоамплитудными колебаниями различной частоты, а иногда и невысокой синхронизированной тета-активностью.
В начале фазы медленного сна на ЭЭГ могут появляться синусоидальные колебания тета-диапазона частотой 4–6 кол./с амплитуды до 50 мкВ более выраженные в затылочных отведениях и (или) генерализованные вспышки высокоамплитудной медленной активности. Последние могут сохраняться до 2-х летнего возраста.
По мере углубления сна у новорожденных ЭЭГ приобретает альтернирующий характер - возникают высокоамплитудные (от 50 до 200 мкВ) вспышки дельта-колебаний частотой 1–4 кол./с, сочетающиеся с ритмическими низкоамплитудными тета-волнами с частотой 5–6 кол./с, чередующиеся с периодами супрессии биоэлектрической активности, представленной непрерывной низкоамплитудной (от 20 до 40 мкВ) активностью. Данные вспышки длительностью 2–4 с возникают каждые 4–5 с.
В период новорожденности в фазу медленного сна также могут регистрироваться фронтальные острые волны, вспышки мультифокальных острых волн и бета-дельта-комплексы («дельта-бета-щетки»).
Фронтальные острые волны представляют собой бифазные острые волны с первичным позитивным компонентом, за которым следует негативный компонент амплитудой 50–150 мкВ (иногда до 250 мкВ) и часто ассоциируются с фронтальной дельта-активностью.
Бета-дельта-комплексы — графоэлементы состоящие из дельта-волн с частотой 0,3–1,5 кол./с, амплитудой до 50–250 мкВ, сочетающихся с быстрой активностью частотой 8–12, 16–22 кол/с амплитудой до 75 мкВ. Бате-дельта-комплексы возникают в центральных и (или) височно-затылочных областях и, как правило, билатерально-асинхронны и асимметричны.
К месячному возрасту на ЭЭГ медленного сна альтернация исчезает, дельта-активность носит непрерывный характер и в начале фазы медленного сна может сочетаться с более быстрыми колебаниями. На фоне представленной активности могут встречаться периоды билатерально-синхронной тета-активности частотой 4–6 кол/с, амплитудой до 50–60 мкВ.
При углублении сна дельта-активность нарастает по амплитуде и индексу и представлена в виде высокоамплитудных колебаний до 100–250 мкВ, с частотой 1,5–3 кол./с, тета-активность, как правило, низкого индекса и выражена в виде диффузных колебаниями; медленноволновая активность обычно доминирует в задних отделах полушарий..
Начиная с 1,5–2 месяцев жизни на ЭЭГ медленного сна в центральных отделах полушарий появляются билатерально-синхронные и (или) выраженные асимметрично «веретена сна» (сигма-ритм), представляющие собой периодически возникающие веретенообразно нарастающие и снижающиеся по амплитуде ритмические группы колебаний частотой 11–16 кол./с, амплитудой до 20 мкВ.. «Сонные веретена» в этом возрасте еще редки и кратковременны по продолжительности, однако к 3-месячному возрасту они увеличиваются по амплитуде (до 30-50 мкВ) и продолжительности.
Следует отметить, что до 5-месячного возраста «сонные веретена» могут не иметь веретенообразной формы и проявляться в виде непрерывной активности длительностью до 10 с и более. Возможна амплитудная асимметрия «сонных веретен» более 50 %.
«Сонные веретена» сочетаются с полиморфной биоэлектрической активностью, иногда им предшествуют К-комплексы или вертекс-потенциалы.
К-комплекы представляют собой билатерально-синхронные преимущественно выраженные в центральной области двухфазные острые волны, в которых негативный острый потенциал сопровождается медленным позитивным отклонением. К-комплексы могут быть индуцированы на ЭЭГ при предъявлении звукового раздражителя, не пробуждая обследуемого. К-комплексы имеют амплитуду не менее 75 мкВ, и, также как вертекс-потенциалы, у детей раннего возраста могут быть не всегда отчетливыми.
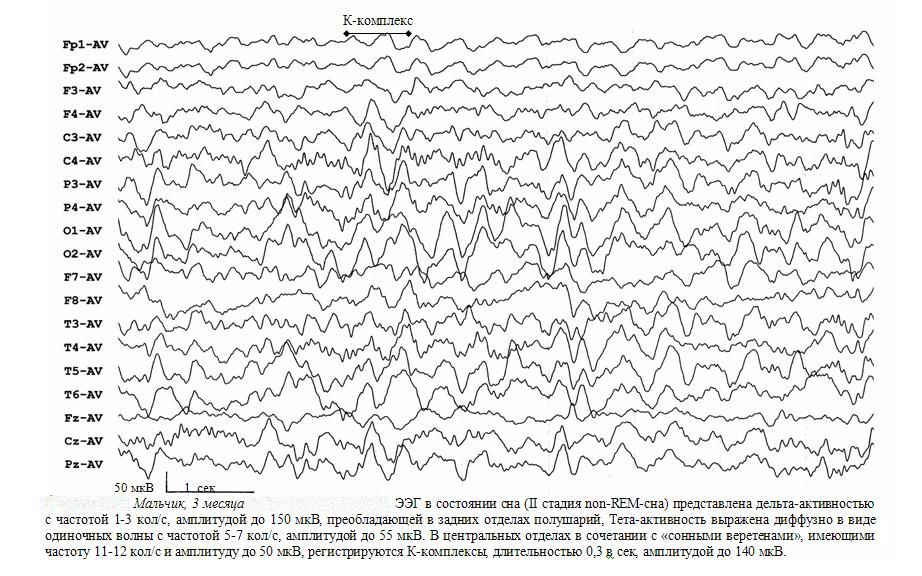
Вертекс-потенциалы (V -волна) является одно- или двухфазными острыми волнами часто сопровождающимися медленной волной с противоположной полярностью, то есть начальная фаза паттерна имеет негативное отклонение, затем следует низкоамплитудная позитивная фаза, а далее медленная волна с негативным отклонением. Вертекс-потенциалы имеют максимальную амплитуду (обычно не более 200 мкВ) в центральных отведениях, могут иметь амплитудную асимметрию до 20 % при сохранении их билатеральной синхронизации..
При неглубоком медленном сне могут регистрироваться вспышки генерализованных билатерально-синхронных полифазных медленных волн.
С углублением медленного сна «сонные веретена» становятся реже и в глубоком медленном сне, характеризующимся высокоамплитудной медленной активностью, обычно исчезают.
С 3 месяцев жизни сон ребенка всегда начинается с фазы медленного сна. На ЭЭГ детей 3–4 месяцев часто при наступлении медленного сна отмечается регулярная тета-активность частотой 4–5 кол./с, амплитудой до 50–70 мкВ, проявляющаяся преимущественно в центрально-теменных отделах.
С 5-месячного возраста на ЭЭГ начинает дифференцироваться I стадия сна (дремота), характеризующаяся «ритмом засыпания», выраженным в виде генерализованной высокоамплитудной гиперсинхронной медленной активности с частотой 2–6 кол./с, амплитудой от 100 до 250. Этот ритм проявляется стойко на протяжении 1–2-го года жизни.
При переходе к неглубокому сну отмечается редукция «ритма засыпания» и амплитуда фоновой биоэлектрической активности снижается. У детей 1–2 лет в это время также могут наблюдаться группы бета-ритма амплитудой до 30 мкВ частотой 18–22 кол./с, чаще доминирующие в задних отделах полушарий.
По данным некоторых авторов фазу медленного сна можно подразделять на четыре стадии, на которые подразделяется медленный сон у взрослых, уже в возрасте 8–12 недель жизни. Однако наиболее сходная со взрослыми картина сна все же отмечается в более старшем возрасте.
У детей старшего возраста и взрослых начало сна знаменуется наступлением фазы медленного сна, в котором, как отмечено выше, выделяют четыре стадии.
I стадия сна (дремота) характеризуется полиморфной невысокой амплитуды кривой с диффузными тета-дельта-колебаниями и низкоамплитудной высокочастотной активностью. Активность альфа-диапазона может быть представлена в виде одиночных волн. Предъявление внешних стимулов может вызвать появление вспышек высокоамплитудной альфа-активности. В этой стадии также отмечается появление вертекс-потенциалов, максимально выраженных в центральных отделах, которые могут встречаться во II и III стадиях сна. Может отмечаться периодическая ритмическая высокоамплитудная медленная активность частотой 4–6 Гц в лобных отведениях.
У детей в этой стадии возможно появление генерализованных билатерально-синхронных вспышек тета-дельта-волн, с наибольшей выраженностью в лобных отведениях с частотой 2–4 Гц, амплитудой от 100 до 350 мкВ. В их структуре можно отметить спайкоподобный компонент (гипнагогическая гиперсинхронизация).
В I-II стадиях могут возникать вспышки аркообразных электропозитивных спайков или острых волн с частотой 14 и (или) 6-7 кол./с продолжительностью от 0,5 до 1 сек. монолатерально или билатерально-асиннхронно с наибольшей выраженностью в задневисочных отведениях.
Также в I-II стадиях сна возможно возникновение преходящих позитивных острые волны в затылочных отведениях (POSTs) — периодов высокоамплитудных билатерально-синхронных (часто с выраженной (до 60 %) асимметрия паттернов) моно- или дифазных волн с частотой 4-5 кол./с, представленных позитивной начальной фазой паттерна с последующим возможным сопровождением низкоамплитудной негативной волной в затылочных отделах. При переходе к III стадии «позитивные затылочные острые волны» замедляются до 3 кол./с и ниже..
Первая стадия сна характеризуется медленным движением глаз.
II стадия сна идентифицируется по появлению на ЭЭГ генерализованных с преобладанием в центральных отделах «сонных веретен» (сигма-ритма) и К-комплексов. У детей старшего возраста и взрослых амплитуда «сонных веретен» составляет 50 мкВ, а длительность колеблется от 0,5 до 2 сек. Частота «сонных веретен» в центральных областях 12–16 кол./с, а в лобных — 10–12 кол./с.
В этой стадии эпизодически отмечаются вспышки полифазных высокоамплитудных медленных волн.
III стадия сна характеризуется нарастанием амплитуды ЭЭГ (более 75 мкВ) и количества медленных волн, преимущественно дельта-диапазона. Регистрируются К-комплексы и «сонные веретена». Дельта волны частотой не выше 2 кол./с на эпохе анализа ЭЭГ занимают от 20 до 50 % записи. Отмечается снижение индекса бета-активности..
IV стадия сна характеризуется исчезновением «сонных веретен» и К-комплексов, появлением высокоамплитудных (более 75 мкВ) дельта волн частотой 2 кол./с и менее, которые на эпохе анализа ЭЭГ составляют более 50 % записи. III и IV стадии сна являются наиболее глубоким сном и объединены под общим названием «дельта сон» («медленноволновой сон»).
Фаза быстрого сна характеризуется появлением на ЭЭГ десинхронизации в виде нерегулярной активности с одиночными низкоамплитудными тета-волнами, редкими группами замедленного альфа-ритма и «пилообразной активностью», представляющей собой вспышки медленных острых волн частотой 2–3 кол./с на восходящий фронт которых накладывается дополнительная заостренная волна, придавая им двузубый характер. Фаза быстрого сна сопровождается быстрыми движениями глазных яблок и диффузным снижением мышечного тонуса. Именно в эту фазу сна у здоровых людей происходят сновидения.
В период пробуждения у детей на ЭЭГ может возникать «лобный ритм пробуждения», представленный в виде ритмичной пароксизмальной островолновой активности частотой 7–10 кол./с, длительностью до 20 сек в лобных отведениях.
Фазы медленного и быстрого сна чередуются на протяжении вceгo времени сна, однако общая продолжительность циклов сна отличается в разные возрастные периоды: у детей до 2–3 лет она составляет около 45–60 минут, к 4–5 годам возрастает до 60–90 минут, у детей старшего возраста — 75–100 минут. У взрослых сонный цикл длится 90–120 минут и за ночь проходит от 4 до 6 циклов сна.
Длительность фаз сна также имеет возрастную зависимость: у детей грудного возраста фаза быстрого сна может занимать до 60 % времени цикла сна, а у взрослых — до 20–25 %. Другие авторы отмечают, что у доношенных новорожденных детей быстрый сон занимает не менее 55 % времени цикла сна, у детей месячного возраста — до 35 %, в 6-месячном возрасте — до 30 %, а к 1 году — до 25 % времени цикла сна. В целом, у детей старшего возраста и у взрослых I стадия сна длится от 30 сек. до 10–15 минут, II стадия — oт 30 дo 60 минут, III и IV стадии — 15–30 минут, фаза быстрого сна — 15–30 минут.
До 5 лет периоды фаз быстрого сна во время сна характеризуются равной продолжительностью. В последующем однородность эпизодов фаз быстрого сна в течение ночи исчезает: первый эпизод фазы быстрого сна становится коротким, тогда как последующие нарастают по продолжительности по мере приближения к ранним yтpенним часам. К 5 годам достигается соотношение между процентом времени, приходящимся на фазу медленного сна и на фазу быстрого сна, практически характерное для взрослых и в первую половину ночи наиболее отчетливо выражен медленный сон, а во второй наиболее продолжительными становятся эпизоды фаз быстрого сна.
Подготовила материал на основе данных https://health-family.ru врач-педиатр Медведева О.В.
Анемия является одной из наиболее частых патологий у детей раннего возраста. Около 20% доношенных детей страдают данным заболеванием, а среди недоношенных на первом году жизни анемия развивается практически у всех. При этом тяжесть анемии тем выше, чем меньше гестационный возраст ре6енка. В первые месяцы жизни у недоношенных детей с очень низкой массой тела при рождении (менее 1500 г) и гестационным возрастом менее 30 нед. тяжелая анемия, требующая переливание эритроцитарной массы, составляет до 90% .
В патогенезе ранней анемии недоношенных играет роль не только формирование железодефицита, характерное для всех детей раннего возраста, но и факторы незавершенного онтогенеза.
Кроветворение во внутриутробном периоде начинается очень рано. Уже в первые 2 нед. развития эмбриона определяются островки кроветворения – эритроциты продуцируются желточным мешком. Начиная с 12–16 нед., основным местом кроветворения становится печень и в меньшей степени селезенка. Примерно в 20 нед. внутриутробного развития плода начинается эритропоэз в костном мозге, а в печени и селезенке постепенно угасает. Таким образом, к моменту рождения у доношенных детей кроветворение в печени почти полностью прекращается, тогда как у глубоконедоношенных очаги кроветворения сохраняются практически до 40-й недели гестации (т.е. от 3 нед. до 3 мес. их фактического возраста). На ранних стадиях внутриутробного развития отмечается небольшое количество эритроцитов. До начала костномозгового кроветворения концентрация эритроцитов в крови плода растет медленно, а к моменту рождения резко возрастает и составляет уже 5–6 млн в 1 мм3.
Для недоношенных детей характерны морфологические изменения эритроцитов. Так, эритроциты аномальной формы составляют 27%, тогда как у доношенных новорожденных всего – 14%. Это способствует тому, что период жизни эритроцита у доношенных почти в 2 раза дольше, чем у недоношенных детей, и составляет 60–70 и 35–50 дней соответственно.
Укорочению жизни эритроцитов могут способствовать особенности строения их мембран. При изучении состава общих липидов мембран эритроцитов у детей с ранней анемией недоношенных выявлено, что со 2-й недели у них наблюдается снижение содержания фосфолипидов и повышается содержание холестерина. Эти изменения прогрессируют к 6-й неделе жизни и в разгар анемии достигают максимума, что коррелирует с клиническими и лабораторными симптомами.
В нарушении проницаемости мембран эритроцитов у недоношенных детей также играет роль низкий уровень витамина Е, который локализуется в мембранах и активно участвует в перекисном фосфорилировании. Дефицит витамина Е наблюдается у 86% недоношенных детей.
Зародышевые эритроциты на ранних этапах онтогенеза продуцируют зародышевую (эмбриональную) форму гемоглобина.
Между 7–12-й неделей внутриутробной жизни эмбриональный гемоглобин заменяется фетальным. Уровень гемоглобина также зависит от срока гестации, составляя на 10-й неделе в среднем 90 г/л, а к 38-й неделе 170±20 г/л.
Фетальный гемоглобин обладает более высоким сродством к кислороду и более медленной отдачей кислорода тканям по сравнению с гемоглобином взрослых. Переключение синтеза фетального гемоглобина на гемоглобин взрослых находится под контролем генов, находящихся в 11 и 16-й хромосомах и начинается на 30–32-й неделе внутриутробного развития. Содержание фетального гемоглобина у недоношенных детей при рождении составляет в среднем 70–80%, у доношенных новорожденных – 60–70%. Более половины объема фетального гемоглобина заменяется на гемоглобин взрослых в первые дни жизни ребенка, в дальнейшем этот процесс несколько замедляется, но к 4–5-му месяцу постнатальной жизни у большинства детей остается около 1% фетального гемоглобина. У недоношенных детей этот процесс замедлен, основной объем смены гемоглобина приходится на 40-ю неделю гестации, а полная смена растягивается практически на весь первый год жизни. Кроме того, задержка переключения синтеза с фетального гемоглобина на гемоглобин взрослых усиливается при тяжелой гипоксии и стрессе у плода.
Уровень гематокрита определяется концентрацией гемоглобина и эритроцитов в крови. В норме гематокрит у новорожденных выше, чем у взрослых, и составляет 50–55%.
Отражением состояния эритропоэза является уровень ретикулоцитов. Среднее количество ретикулоцитов у новорожденного составляет 4,2–7,2%. В конце 1-й недели постнатального возраста этот показатель снижается до уровня взрослых и составляет 1%.
При рождении доношенного ребенка определяется высокое содержание гемоглобина, что в условиях повышенного по сравнению с внутриутробным потреблением кислорода является избыточным. Это в свою очередь ведет к усилению выработки эритропоэтина и снижению эритропоэза. При угнетении функции костного мозга и усиленном разрушении эритроцитов происходит постепенное снижение и смена гемоглобина, который к 8–12-й неделе у доношенных детей достигает 110–120 г/л. Если гемоглобин снижается до этого порога – для доношенных 100–110 г/л, нарушается отдача кислорода тканям, что стимулирует продукцию эритропоэтина. В результате начинается процесс увеличения продукции эритроцитов.
У недоношенных детей процесс разрушения эритроцитов идет быстрее в связи с более коротким периодом жизни этих клеток. Уровень гемоглобина, при котором начинает увеличиваться продукция эритропоэтина у недоношенных детей, значительно ниже, чем у доношенных, и составляет 90–70 г/л (таким образом, такой уровень гемоглобина – критический для доношенных детей, является допустимым для недоношенных!).
У взрослых и детей старшего возраста в ответ даже на легкую гипоксию наблюдается быстрое увеличение продукции эритропоэтина, в то время как недоношенные не способны продуцировать адекватные количества эритропоэтина даже при критических значениях циркулирующих эритроцитов, что обусловлено, по-видимому, более низкой потребностью в кислороде.
Таким образом, анемия недоношенных характеризуется прогрессивным снижением уровня гемоглобина (до 90–70 г/л и ниже), относительно низким уровнем ретикулоцитов и угнетением костномозгового кроветворения.
Выделяют раннюю и позднюю анемию недоношенных.
Ранняя анемия развивается на 4–10-й неделе постнатальной жизни и характеризуется снижением уровня ретикулоцитов менее 1%, уровня гемоглобина до 80–70 г/л и ниже, а гематокрита до 20–30%
Клиническая картина ранней анемии недоношенных проявляется симптомами, свойственными истинной анемии, такими как бледность кожных покровов, тахикардия или брадикардия, тахипное, апноэ.
Среди причин ранней анемии недоношенных, кроме указанных, определенное значение придается высокой скорости увеличения массы тела и объема циркулирующей крови, несоизмеримых с уровнем эритропоэза.
Кроме того, в генезе ранней анемии недоношенных играет роль дефицит фолиевой кислоты, витамина В6, микроэлементов: цинка, меди, селена, молибдена. Запасы фолиевой кислоты истощаются в течение первых недель жизни, что приводит к нарушению синтеза фолатов микрофлорой кишечника.
Известно, что ранняя анемия недоношенных может быть одним из проявлений инфекции и потенцироваться ее постнатальным развитием.
Кроме "условно физиологических" причин анемии, связанных с незавершенным онтогенезом, к сожалению, в потенцировании тяжести анемии определенную роль играют так называемые ятрогенные причины, такие как частые, хоть и небольшие по объему кровопотери в результате заборов крови для лабораторных исследований без восполнения ОЦК. По данным литературы, за первую неделю жизни у новорожденного недоношенного ребенка для исследований забирается около 38,9 мл крови. Относительно общего объема крови (80 мл/кг массы) это – очень большая цифра.
Суммируя все сказанное, в патогенезе анемии недоношенных играют роль сочетание нескольких факторов:
а) укороченная продолжительность жизни эритроцитов;
б) пролонгированная циркуляция и поздняя смена фетального гемоглобина;
в) особенность обмена белков, витаминов, микроэлементов;
г) инфекционные агенты, в частности грамотрицательная флора, для жизнедеятельности которой необходимо активное потребление железа;
д) ятрогенные причины.
Одним из основных методов лечения ранней анемии недоношенных до настоящего времени остаются гемотрансфузии. Наиболее часто для гемотрансфузий используется донорская эритроцитарная масса. Показаниями для переливаний эритроцитарной массы при анемии недоношенных являются: снижение гемоглобина ниже 130 г/л и гемотокрита ниже 0,4 в период ранней адаптации (первые 7 дней жизни) в сочетании с тяжелыми нарушениями дыхания и сердечной деятельности. Широкое использование гемотрансфузий у недоношенных детей сопряжено хотя и с невысоким, но существенным риском. Это прежде всего возможность передачи с трансфузиями вирусных инфекций (ВИЧ, ЦМВ), возможны также перегрузки сосудистого русла жидкостью, развития состояния "трансплантант против хозяина", электролитного дисбаланса. В настоящее время ведется поиск альтернативных путей решения этой проблемы. Одной из них является применение рекомбинантного человеческого эритропоэтина, эффективность которого сейчас интенсивно изучается.
Поздняя анемия недоношенных развивается на 3–4-м месяце жизни. Она имеет большее сходство с железодефицитной анемией детей раннего возраста. Клиническая картина поздней анемии недоношенных характеризуется снижением аппетита, уплощением весовой кривой, бледностью кожи и слизистых оболочек, сухостью кожи, увеличением печени и селезенки. Отмечается снижение сывороточного железа – гипохромия, с тенденцией к микроцитозу и гиперрегенераторной реакцией костного мозга.
Кроме всех особенностей, присущих ранней анемии недоношенных, в период развития поздней анемии начинают проявляться симптомы дефицита железа. Наиболее активное поступление железа от матери к плоду осуществляется в последние 2 мес. беременности, поэтому недоношенность в 4–8 нед. может привести к сокращению запасов железа в 1,5–3 раза по сравнению с доношенными.
У доношенных детей ретикулоэндотелиальная система имеет запас железа на 15–20 дней. Как только достигается нижний уровень гемоглобина – 100–110 г/л у доношенных и 70–90 г/л у недоношенных, начинается стимуляция эритропоэза. Если запасов железа недостаточно, происходит дальнейшее снижение гемоглобина и анемия становится железодефицитной. У недоношенного ребенка потребность в железе выше, чем у доношенного, а запасов разительно меньше. Учитывая, что железо находится в организме не только в виде гема, но также идет на построение миоглобина и ферментов – каталазы, пероксидазы, цитохромов и цитохромоксидазы, постнатальный расход его крайне велик.
После рождения источниками железа для развивающегося организма являются поступление экзогенного железа в составе пищевых продуктов и его утилизация из эндогенных запасов.
Попытки обогащения рациона питания введением адаптированных смесей, в том числе и обогащенных железом, не приводят к желаемому результату, поскольку последнее плохо всасывается. Для недоношенных детей, особенно первых месяцев жизни, единственным физиологическим продуктом питания, который обеспечивает равновесие обмена железа в организме, является материнское молоко, сбалансированное по всем ингредиентам в соответствии с физиологическим потребностям растущего организма. Хотя в женском молоке содержание железа невелико (0,2–1,5 мг/л), существуют специальные механизмы для более эффективного его усвоения (до 50%) [8]. Вместе с тем большой проблемой является поддержание лактации у женщин, находящихся в состоянии стресса в результате досрочно прерванной беременности и больного ребенка. Просветительская работа, психологическая поддержка матери являются единственным способом обеспечения грудным вскармливанием недоношенного ребенка.
Для диетической коррекции железодефицита требуется своевременное (но не ранее 4–5-го месяца жизни) введение продуктов прикорма (фруктов, овощей, в дальнейшем, после 8 мес. – мяса). В то же время исследованиями доказано, что для лечения анемии (но не для ее профилактики) недостаточно только повышения уровня пищевого железа, а требуется медикаментозная дотация.
Чем же так опасна железодефицитная анемия?
Железодефицитная анемия способствует развитию хронической гипоксии, которая в свою очередь может приводить к замедлению умственного и психомоторного развития ребенка.
В связи с этим лечение анемии у недоношенных детей и профилактика дефицита железа у всех детей является важной и обязательной составной частью в общей схеме наблюдения за детьми на 1-м году жизни. Кроме немаловажных диетических подходов, актуально раннее назначение профилактических доз препаратов железа всем недоношенным детям. Препаратами выбора в этом случае являются современные представители гидроксид полимальтозного комплекса трехвалентного железа: Мальтофер и Феррум Лек. Гидроксид полимальтозный комплекс стабилен в физиологических условиях, что исключает образование свободных ионов железа. В отличие от распространенных ранее солевых (ионных) препаратов железа - двухвалентные соединения солей железа (например, сульфат железа), полимальтозные комплексы (Мальтофер и Феррум Лек) не оказывают раздражающего действия на слизистую оболочку кишечника, что часто проявляется в виде запора, диареи, тошноты, срыгиваний. Всасывание железа из полимальтозных комплексов приближена к абсорбции гемового железа и обеспечивается активным транспортным механизмом, наиболее физиологичным для организма. В данном случае железо непосредственно переносится через трансферриновые рецепторы в места кроветворения или доставляется в места хранения железа, где депонируется в ретикулоэндотелиальной системе (печени и селезенке) в виде ферритина.
Клинические исследования препарата “Мальтофер” показали его одинаковую эффективность по сравнению с солевыми препаратами. При этом количество побочных эффектов со стороны желудочно-кишечного тракта в 3 раза меньше при применении полимальтозного комплекса железа, а число пациентов, отказавшихся от продолжения курса лечения, более чем в 2 раза больше в группе солевых препаратов.
Химическая структура комплекса не выделяет железо в свободном виде. Совместно с активным транспортным механизмом всасывания железа это предохраняет организм от интоксикации свободными ионами железа [11], а также их оксидативного воздействия, присущее солевым препаратам железа.
Эти же механизмы поддерживают систему саморегуляции по принципу "обратной связи": всасывание железа из комплекса прекращается, как только восстанавливается его необходимый уровень в организме, что исключает возможность отравления данными препаратами при их передозировке
Недоношенным детям с первых недель жизни до 1-го года рекомендуется профилактический прием указанных препаратов железа из расчета 2 мг/кг/сут элементарного железа. Лечебная доза составляет 5 мг/кг/сут элементарного железа и не меняется до нормализации уровня гемоглобина. Контроль показателей красной крови (уровень гемоглобина, ЦП, эритроциты) недоношенным детям после выписки из отделений выхаживания необходимо проводить в обязательном порядке в 3, 6 и 12 мес, затем 2 раза в год, а при выявлении анемии – каждые 14 дней до стабилизации показателей гемограммы.
Учитывая особенности патогенеза анемии недоношенных детей, тенденцию к развитию гипорегенераторной реакции костного мозга, мегалобластозу, макроцитозу, повышенному гемолизу эритроцитов, детям с низкой массой тела при рождении необходимо раннее, с 7 дней жизни, введение фолиевой кислоты по 1 мг в сутки, витамина Е по 20 мг/кг в сутки, витаминов группы В.
Согласно МУ «Вакцинопрофилактика. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок» нетяжелая железодефицитная анемия не является противопоказанием к вакцинации. Напротив, недоношенные дети представляют особую группу риска по развитию осложненного инфекционного процесса. Поэтому даже в случае тяжелых проявлений анемии профилактические прививки могут быть проведены сразу после купирования острых проявлений. Умеренное снижение гемоглобина, проведение противоанемического лечения не является основанием для отсрочки вакцинации.
Литература
- Бисярина В.П., Казакова Л.М. Железодефицитная анемия у детей раннего возраста. М., 1979; 176.
- Nex E., Cristensen N.S., Olesen S. Volume of blood removed for analytical purposes during hospitalization of low birth weight infants. Clinical chemistry, 1981; 27: 759–61.
- Алдышева Т.В. Соединение веществ в плазме крови и активность антиокислительных ферментов эритроцитов при наличии анемии недоношенных детей. Вопросы адаптации недоношенных и детей грудного возраста. М., 1985; 127–30
- Дегтярев Д.Н., Курмашева Н.А., Володин Н.Н. Современные представления о патогенезе и лечении анемии у недоношенных детей. Лекции кафедры неонатологии ФУВ РГМУ, 1994.
- Dallmann P.R. Nutritional anemia in infancy in Tsang R.C., Nicols B.L. Nutrition during infancy, Philadelphia, 1988.
- Красницкая Л.Н. Содержание тиреоидных гормонов, тестостерона и кортизола в сыворотки крови у недоношенных детей при ранней анемии. Автореф. дисс. канд.мед.наук, Л., 1988; 22.
- Пригожина Т.А. Эффективность рекомбинантного эритропоэтина в комплексной профилактике и лечении ранней анемии недоношенных. Дисс. канд.мед.наук, М., 1988.
- Акре Д. Кормление детей первого года жизни: функциональные основы. Бюллетень ВОЗ, 1989; приложение к тому 67: 30–35.
Подготовила заведующий консультативно-диагностическим отделением - врач-педиатр Медведева О.В.
Рентгенологическая диагностика аномалий развития ШОП необычайно разнообразна и варьирует от минимальных нарушений формы, размеров и соотношения частей тел, дужек и отростков позвонков до грубых уродств, таких как отсутствие или неоднородное слияние частей или целых отделов позвоночника. Аномалии возникают вследствие нарушения естественных процессов развития позвонка.
Помимо аномалий развития позвонков на этом же сегментарном уровне регулярно встречаются аномалии развития нервной системы, кожи и внутренних органов, что говорит о единстве процессов развития и анатомической организации органов и систем одного склеротома.
Важно диагностировать не только уродства, выраженные аномалии развития, но и минимальные вариации формы и структуры позвонков, которые и являются ключевыми при анализе биомеханики позвоночника пациента.
В. Путти с целью объяснения возникновения аномалий развития позвоночника предложил использовать схему элементарного позвонка, который состоит из шести частей. В телах позвонков образуется одна пара костных зачатков, дужка позвонка формируется из двух парных зачатков, еще одна пара костных ядер дает начало ребрам.
В.А. Дьяченко предложил разделить аномалии на две группы: 1) онтогенетического значения; 2) филогенетического значения.
К 1-й группе он отнес те аномалии позвонка, которые возникают в эмбриональном периоде в результате нарушения плана развития и являются пороками эмбриогенеза.
Ко 2-й группе В.А. Дьяченко отнес аномалии числа позвонков. Они локализуются на границах отделов позвоночника и появляются в результате нарушения прохождения эмбрионом фаз исторического развития. (ассимиляция атланта, тораколизация, цервикализация, люмбализация, сакрализация) и чаще являются причиной диспластического сколиоза или кифоза.
Наиболее часто встречаемые аномалии в ШОП:
Аномалии развития позвонков:
Конкресценция одного или нескольких позвонков.
На снимках в боковой проекции визуализируется полное или частичное сращение тел и отростков позвонков.
Бабочковидный позвонок.
Определяется на снимках в прямой проекции в виде центрального дефекта и расщепления тела позвонка.
Боковой или задний клиновидный позвонок.
Возникает из-за недоразвития одной половины тела, образования сверхкомплектного клиновидного позвонка или нарушения симметричного слияния клиновидных позвонков на разных уровнях. На рентгенограмме в прямой проекции боковой клиновидный позвонок имеет лишь одну половину дужки, одну пару суставов, и один поперечный отросток. При нарушении формирования передних отделов тела на снимках в боковой проекции определяется задний клиновидный позвонок.
Аномалии формы и размеров тел позвонков.
Платиспондилия - уплощение и увеличение переднезаднего размера.
Брахиспондилия - уменьшение переднезаднего размера тела позвонка.
Так же можно увидеть позвонки ящикообразной, вазообразной или клиновидной формы.
Седловидная гиперплазия боковых масс атланта:
на рентгенограмме краниовертебральной зоны в сагиттальной проекции отмечается увеличение боковых масс атланта, верхняя площадка которых формирует изгиб в форме седла для сочленения с мыщелками затылочной кости.
Гипоплазия (уменьшение вертикального размера зуба по отношению к высоте тела второго позвонка) или аплазия зуба С2 (отсутствие его), несращение зуба С2 с телом С2 позвонка.
Лордозирование (отклонение в разной степени зубовидного отростка кзади), редко кифозирование (отклонение его кпереди).
Зубовидная кость –несращение верхушки зуба с телом зуба С2 и смещение ее кпереди в полость сустава Крювелье или кзади. Все эти аномалии ведут к нарушению статики и биомеханики краниовертебрального перехода. Смещенная зубовидная кость может являться показанием для оперативного лечения.
Незаращение передней дужки атланта рентгенологически проявляется наличием полосы просветвления в середине передней дужки.
Аномалии развития дужки и отростков позвонков:
Аномалия Киммерле
Превращение борозды позвоночной артерии, располагающейся на дуге атланта, в канал (вследствие образования костного мостика над этой бороздой) . На рентгенограмме краниовертебральной зоны в боковой проекции визуализируется костная дужка или полудужка, соединяющая задний край боковой массы и заднюю дужку атланта, может быть одиночная или двухсторонняя,.
Незаращение задней дужки С1
Аномалия диагностируется на фронтальных рентгенограммах с открытым ртом или на рентгенограмме в боковой проекции. Это центрально расположенная, часто под углом к тени дужки атланта, полоса просветления, локализующаяся в пределах контуров задней дужки. В затруднительных случаях помогает рентгенограмма в сагиттальной проекции. В норме два зачатка дужки атланта, сливаясь, образуют костную основу задней стенки позвоночного канала. Рентгенологически это проявляется в виде четкого контура, отделяющего тень основания остистого отростка. Исследуя тень остистого отростка на сагиттальной рентгенограмме любого шейного позвонка, можно провести четкую замкнутую линию. Отсутствие внутреннего контура этой линии и есть диагностический признак незаращения дужки позвонка. Сама тень дужки представляется удвоенной, поскольку две ее половинки проекционно накладываются одна на другую.. Так же можно увидеть spina bifia любого другого или нескольких шейных позвонков.
Аномалии развития суставных отростков позвонков –их асимметрия, что сопровождается компенсаторным приспособлением формы и размеров остальных отростков на этом же уровне или в вышестоящих позвоночно-двигательных сегментах. На рентгенограммах можно диагностировать аномалии развития поперечных, остистых отростков (раздвоение, агенезия, гипоплазия) и др.
Иногда визуализируется аномалия развития позвоночного канала- его стеноз.
Аномалии развития переходных зон позвоночника:
1.Аномалии краниовертебрального перехода.
Ассимиляция атланта
Ассимиляция атланта заключается в том, что его боковые массы или дуги частично или полностью сливаются с затылочной костью. Различают: 1) ассимиляцию атланта в виде полуатланта, когда к затылочной кости прикрепляются боковая масса и поперечный отросток; 2) полное слияние боковых масс атланта без поперечных отростков; 3) прирастание передней и частично задней дуги атланта; 4) слияние суставных отделов и половины атланта.
Манифестация проатланта
Манифестация проатланта - дополнительное костное образование, происходящее из краев большого затылочного отверстия. Имеется много вариаций: передние, задние, боковые проатланты, слившиеся и ненслившиеся с дужками С1,зубом С2, с базионом,или затылочной костью, оиночные или множественные. На снимках визуализируются как дополнительные костные фрагменты.
2. Аномалии шейно-грудного перехода.
Тораколизация 7-го шейного позвонка (гиперплазия поперечных отростков С7 или шейные ребра)
При 1 степени на рентгенограммах шейного отдела позвоночника в прямой проекции определяется гиперплазия поперечных отростков С 7 до размера поперечных отростков 1-го грудного позвонка. Может быть без или с зачатками истинных ребер. При 2 степени шейное ребро выходит за пределы грудного поперечного отростка, но не достигает хрящевой части 1 ребра. При 3 степени шейное ребро достигает хрящевой части 1 ребра и соединяется с ним. Пори 4 степени полностью сформированное шейное ребро соединяется с хрящом 1 ребра и вместе с ним или самостоятельно соединяется с грудиной.
Аномалия Клиппеля-Фейля.
Это нарушение сегментации, которое приводит к блокированию тел, дуг и отростков позвонков.
На рентгенограмме шейного отдела позвоночника во фронтальной проекции шейные позвонки С3 - С7 представляют собой костную массу, состоящую из двух или более сросшихся и деформированных (бабочковидных, клиновидных и или полупозвонков). Часто может сочетаться с болезнью Шпренгеля (высоким стоянием лопатки).
Материал подготовила врач-рентгенолог Ксензова А.Ф.
Локтовой нерв формируется из среднего пучка плечевого сплетения. На предплечье и кисти нерв иннервирует мышцы, осуществляющие ладонное сгибание и отведение кисти в локтевую сторону.
В нижней части предплечья от нерва отходят ладонные и дорзальные кожные ветви. На уровне запястья нерв проходит через канал Гиойна, после чего раздваивается на поверхностные и глубокие ветви. Поверхностная ветвь иннервирует m.palmarisbrevis и затем отдает чувствительные ветви к пятому пальцу и половине безымянного пальца.
Глубокая ветвь иннервирует мышцы гипотенара.
На кисти могут наблюдаться аномалии иннервации, так, например, все мелкие мышцы кисти могут иннервироваться только локтевым или срединным нервом.
Кроме того, между срединным и локтевым нервами могут быть физиологические анастомозы, которые необходимо учитывать при проведении электромиографии.
Самая частая причина мононевропатии n. ulnaris является травма. Проксимальные мононевропатии могут возникать при надмышелковом переломе, эпикондилярном переломе, переломе костей предплечья, травме локтя, колотых ранах и при пункции вены.
Дистальные лучевые переломы могут стать причиной повреждения нерва на уровне запястья.
Возможно отсроченное повреждение нерва после травмы в связи с формированием фиброзных изменений.
Другая причина – компрессия нерва при проведении хирургических процедур, после сна при неудобном положении руки, рулем велосипеда.
Редкие причины компрессии нерва: кровоизлияния при гемофилии, фокальной гипертрофической невропатии, ожоги, опухоли, гамартомы.
При проведении ЭНМГ вначале исследуют сенсорный ответ от пятого пальца кисти, проведение по двигательным волокнам оценивается при регистрации М-ответа с мышц гипотенара. Оцениваются скорости проведения на уровне предплечья и сегментам локтя. Сравниваются параметры с проведением по сенсорным и моторным волокнам срединного нерва. При необходимости проводится игольчатая ЭМГ mm. first dorsal interosseus, abductor digiti minimi, flexor carpi ulnaris.
Подготовила заведующий центром нервно-мышечной патологии — врач функциональной диагностики Симонова Е.Н.
Миастения и миастенический синдром – заболевания, связанные с патологией нервно-мышечной передачи на уровне пре- и постсинаптической мембраны. Миастения – аутоиммунное заболевание, при котором антитела направлены против ацетилхолиновых рецепторов на постсинаптической мембране. Миастенический синдром (или синдром Ламберта-Итона) представляет собой заболевание, связанное с выработкой антител к потенциалзависимым кальциевым каналам нервных окончаний. При данных заболеваниях наблюдается преходящая утомляемость и слабость, усугубляющаяся в конце дня и проходящая после отдыха, птоз и слабость наружных глазных мышц. Часто возникает диплопия.
Идентифицировано несколько генетических дефектов, которые вызывают семейную инфантильную миастению. Фенотипически различают два клинических синдрома миастения с доминированием дыхательных расстройств и трудностями питания и врожденной миастенией с преимущественно глазными проявлениями. В основе патогенеза семейной инфантильной миастении может лежать как нарушение ресинтеза ацетилхолина и его квантового накопления, так и врожденный дефицит ацетилхолинэстеразы.
Помимо этого, существует транзиторный миастенический синдром у детей, матери которых страдают миастенией. Синдром развивается в результате пассивного транспорта антител против ацетилхолиновых рецепторов от больной миастении матери к ребенку.
Диагностике содействует выявление декремента амплитуды следующих друг за другом потенциалов при повторной низкочастотной стимуляции нерва.
На ЭНМГ выявляется снижение амплитуды М-ответа при повторной электростимуляции нервов, так называемый «декремент-тест». В норме десятый по счету потенциал не должен быть более чем на 10% слабее, чем первый для дистальных мышц и на 20% для проксимальных мышц.
Ценность декремент-теста заключается в том, что он позволяет отдифференциировать истинную миастению от миастенических синдромов.
При проведении декремент-теста на область исследуемой мышцы (тест проводится на дельтовидной, трехглавой, двубрюшной мышцах или на круговой мышце глаза) накладываются электроды, которые подключаются к электромиографу. По стимулирующему электроду поступают импульсы электрического тока с частотой 3 Гц, при этом пациент может испытывать неприятные ощущения, покалывания и отмечает подергивание мышцы.
Электромиограф осуществляет регистрацию мышечных сокращений - М-ответ. Электромиограмма на электрическую стимуляцию записывается в виде нескольких, накладывающихся друг на друга кривых. У здорового человека затухание (декремент) М-волны не превышает 10% по отношению к первым импульсам, так как нервно-мышечная передача обладает большим запасом надежности.
Постепенное снижение амплитуды М-волн по сравнению с первой (более чем на 10%) позволяет заподозрить миастению, так как при этой патологии надежность нервно-мышечной передачи значительно ослаблена.
После установления степени декремента переходят к дополнительным пробам на постактивационное облегчение и постактивационное истощение. Именно эти пробы позволяют дифференциировать миастению и миастенический синдром, т.к. и в том и другом случае при низкочастотной стимуляции будет регистрироваться декремент. При миастеническом синдроме наблюдается феномен посттетанического (постактивационого) облегчения. Кроме того, при миастеническом синдроме М-ответ может быть снижен изначально.
По материалам руководств «Педиатрическая неврология: основы клинической диагностики» Джеральд М. Феничел и «Нерология в фокусе» под редакцией В.В, Захарова
Подготовила заведующий центром нервно-мышечной патологии — врач функциональной диагностики Симонова Е.Н.
Поскольку распространенность болезни Альцгеймера (БА) продолжает расти, поиск способов ее лечения и профилактики становится все более актуальным. Новые лицензированные методы лечения, такие как адуканумаб и леканемаб, очищающие мозг от бета-амилоида, являются существенным подспорьем, но они дороги и вызывают споры.
Многие ученые в настоящее время изучают другие области, одной из которых является влияние микробиома (микробов и бактерий, населяющих кишечник) на нейродегенеративные расстройства.
Появляется все больше свидетельств того, что у людей с болезнью Альцгеймера микробиом кишечника может быть другим, чем у людей без этого заболевания. Однако пока не ясно, являются ли эти различия в микробиоме причиной или следствием болезни Альцгеймера.
Новое исследование Медицинской школы Вашингтонского университета в Сент-Луисе, опубликованное в журнале «Science», показало, что кишечные бактерии влияют на иммунные реакции в мозге мышей и могут способствовать риску развития нейродегенеративных заболеваний.
Связь между кишечными бактериями и болезнью Альцгеймера
Широко признано, что микробиом влияет на общее состояние здоровья, но только в последние 15 лет ученые начали говорить о важности так называемой оси кишечник-мозг.
Микробиом человека меняется на протяжении всей его жизни под влиянием факторов окружающей среды и образа жизни, таких как диета. Микробиом может влиять на развитие нейродегенеративных заболеваний, таких как болезнь Альцгеймера, а также меняться в зависимости от статуса заболевания. Измененные кишечные бактерии (дисбактериоз) могут препятствовать клиренсу бета-амилоида, повышать проницаемость кишечника и гематоэнцефалический барьер или изменять иммунные и воспалительные реакции.
Нейродегенарация от некоторых бактерий
В этом исследовании мыши были генетически модифицированы для развития повреждения мозга, подобного болезни Альцгеймера и когнитивных нарушений. Все они несли вариант гена АРОЕ, который является генетическим фактором риска развития болезни Альцгеймера, и транслировали мутантную форму тау-белка, обнаруженного в мозге человека. Тау-белок связан с развитием симптомов БА.
Мыши были разделены на 2 группы. Одна группа с рождения воспитывалась в стерильных условиях, поэтому микробиом не развился, в то время как другим в раннем возрасте давали антибиотики, чтобы изменить состав их микробиома.
Всех мышей кормили типичной лабораторной диетой. Через 40 недель мозг мышей, которые с рождения содержались в стерильных условиях, демонстрировал гораздо меньшую нейродегенерацию, чем мозг мышей с типичным мышиным микробиомом.
При этом мыши-самцы показали меньшее повреждение мозга, чем мыши-самки, получавшие такое же лечение. Однако трудно сказать, что именно это означает для мужчин и женщин, живущих с болезнью Альцгеймера и связанными с ней расстройствами.
Влияние 3 жирных кислот
Ученые обнаружили, что три короткоцепочечные жирные кислоты, вырабатываемые некоторыми типами кишечных бактерий, ведут к нейродегенерации. Эти жирные кислоты отсутствовали у мышей без микробиома и были очень низкими у мышей, получавших антибиотики. Ученые предполагают, что эти жирные кислоты активировали иммунные клетки, которые повреждали ткани головного мозга. Чтобы проверить это, они скармливали три жирные кислоты мышам среднего возраста без микробиома. Затем их иммунные клетки мозга стали более активными и в мозгу появилось больше признаков повреждения, связанного с тау-белком.
Возможное лечение БА
Полученные данные дают представление о том, как микробиом может влиять на тау-опосредованную нейродегенерацию у людей. Ученые предполагают, что изменение кишечного микробиома с помощью антибиотиков, пробиотиков, специализированных диет или других средств может стать новым подходом к профилактике и лечению нейродегенеративных заболеваний, таких как БА. А изучение сложного влияния кишечного микробиома на болезнь Альцгеймера приведет к созданию новых терапевтических средств для предотвращения и смягчения нейродегенерации.
Подготовила врач-педиатр Корнилова И.Ю.
Ультразвуковое исследование периферических нервов принципиально не отличается от общей эхографии. В 1988 году Bruno Fornage сообщил о возможности визуализации периферических нервов. В последующем УЗИ периферических нервов совершенствовалось, однако развитие данной методики было затруднено в связи с небольшими размерами нервов, что осложняло визуализацию с помощью обычных линейных датчиков. Главной проблемой являлось отсутствие датчиков высокого разрешения, поэтому настоящий бум развития УЗИ периферических нервов наступил только в конце 1990-х — начале 2000-х и продолжается до сих пор.
Интерес к УЗИ периферических нервов вырос со стороны лучевых диагностов, неврологов и анестезиологов. Во многом это связано с техническим прорывом в производстве УЗ- «сканеров», высокочастотных датчиков и программного обеспечения. Периферические нервы представляют собой небольшие «топографически сложные структуры», поэтому поддержание высокого качества как диагностического УЗИ нервов, так и УЗ-контроля манипуляций требует применения целого арсенала инструментов и приборов.
Ультразвуковое исследование позволяет неинвазивно сканировать периферические нервы с получением количественных и качественных характеристик. Метод позволяет определять анатомическую целостность нерва и соотношение с окружающими тканями на протяжении большого участка, доступного визуализации. Высокая воспроизводимость результатов, методическая простота и информативность определяет растущий интерес к УЗИ нервов в педиатрической практике. Несмотря на то, что визуализация периферических нервов при стандартной МРТ является более качественной, УЗИ имеет определенные преимущества:проведение обследования у постели больного любого возраста, одномоментное сканирование моторных и сенсорных нервов конечностей, исследование нерва на большом протяжении и в труднодоступных местах с учетом специфического хода, относительно малая стоимость исследования. Недостатком метода в ряди случаев является методическая сложность обследования пациентов с избыточным весом, невозможность унификации в толковании результатов в связи с использованием датчиков с различной разрешающей способностью, а также субъективность в оценке полученных данных, связанная с опытом специалиста.
При поперечном сканировании нерв представляет собой овальное или округлое образование с четкими гиперэхогенными контурами и внутренней гетерогенной упорядоченной структурой (по типу «медовых сот»), при продольном сканировании нерв лоцируется в виде линейной структуры с четкими гиперэхогенными контурами, в составе которой правильно чередуются гипо- и гиперэхогенные полосы (по типу «электрического кабеля»). Это позволяет отличить нерв от любых расположенных рядом образований, например, сухожилий и сосудов. При УЗИ проводиться как количественная, так и качественная оценка состояния нервных стволов.
Сегодня УЗИ периферических нервов является дополнительной к электродиагностике методикой и используется для визуализации нервов у детей при различных патологических состояниях (травмах, опухолях, туннельных и нетуннельных компрессиях, полинейропатиях).
Подготовила врач ультразвуковой диагностики Шишова Л.В.
Наследственная тугоухость – нарушение слуха, наследуемое в семье. Причиной является наследование измененных генов. При этом семья может знать, а может и не знать, о случаях тугоухости в других поколениях. Вероятно, Вы уже знаете, что гены являются носителями наследственной информации, которая определяет развитие целого организма из одной оплодотворенной яйцеклетки. Каждый ген в отдельности отвечает за образование определенного белка и может иметь несколько вариантов своего строения. Одни варианты являются нормальными, а другие приводят к развитию патологии. Все мы получаем по две копии каждого гена – одну от матери, другую от отца. Таким образом, каждый человек имеет два варианта одного и того же гена. Ряд генов в организме отвечает за образование и работу органа слуха. В общей сложности таких генов не менее 100. Не удивительно, что согласно данным последних исследований более 50% всех случаев врожденной и ранней детской тугоухости связано с наследственными причинами. Считается, что каждый восьмой житель Земли является носителем одного из генов, вызывающих рецессивную тугоухость.
Какой тип наследственной тугоухости наиболее часто встречается?
Около 75% всех случаев наследственной тугоухости относятся к рецессивным несиндромальным формам нарушения слуха (РННС) или рецессивной несиндромальной тугоухости.
При рецессивном типе наследования ребенок получает от каждого из родителей один и тот же патологический вариант гена, который вызывает данную форму нарушения слуха (см. рис.). «Рецессивный» ген проявляется лишь в паре с другим таким же геном. При этом родители ребенка не страдают нарушением слуха, так как они имеют один нормальный вариант данного гена в паре генов, полученных от своих родителей.
Тем не менее, они являются носителями гена рецессивной несиндромальной глухоты. Таким образом, у ребенка может быть нарушение слуха, тогда как его родители и все другие родственники имеют нормальный слух в любом возрасте.
Под несиндромальной формой понимают то, что снижение слуха не сопровождается другими признаками или заболеваниями других органов и систем, которые передавались бы по наследству вместе с тугоухостью, что имеет место при синдромальных формах (например, синдром Пендреда – это синдром, характеризующийся сочетанием нарушения слуха и нарушения функции щитовидной железы).
Каким образом ребенок получает РННС?
Итак, каждый из нас получает половину наших генов от отца и другую половину от матери. Какой ген из родительской пары генов мы получаем – явление чисто случайное.
Время от времени воздействие каких-либо факторов может вызывать изменение гена. Генетики называют это изменение мутацией. Многие люди и не подозревают о том, что они являются носителями измененных генов. Данные изменения, однажды возникнув, передаются по наследству из поколения в поколение. Большинство мутаций не влияют на состояние организма, но иногда некоторые из них в силу ряда причин проявляют свое действие. Одной из причин является встреча двух носителей одного и того же измененного гена. Они могут стать родителями ребенка с рецессивной несиндромальной глухотой (см. рис.). Этот ребенок получает измененный ген от каждого из родителей и таким образом, будет иметь две копии измененного гена. Только в данном случае из-за отсутствия нормального варианта гена мутация проявляет свое действие. Для этих родителей риск рождения ребенка с врожденной несиндромальной глухотой составляет 25%.
Как правило, степень потери слуха изначально достаточна для коррекции и обучения
Дети с нормальным слухом в данном браке могут родиться в 75% случаев, причем часть детей могут иметь здоровый генотип (25%) и им в будущем ничто не угрожает, а другие, как и их родители, являются носителями измененного гена (50%) и для них ситуация может повториться.
Каким образом ребенок получает РННС?
Самым значимым для развития тугоухости оказался ген коннексина 26. Только одно изменение в этом гене – мутация 35delG, отвечает за 40% всех случаев врожденной и доречевой детской тугоухости. Известны и другие изменения в этом гене. Благодаря проведенным исследованиям показано, что в ряде регионов нашей страны каждые 4 человека из 100 являются носителями мутации 35delG. Поэтому вероятность встречи носителей измененного гена очень высока. Предварительный анализ гена при планировании потомства может выявить носительство.
Выявление носительства одной патологической мутации у здоровых лиц является поводом для беспокойства о риске врожденной тугоухости для их детей. На практике мы часто сталкиваемся с ситуацией, когда сведения о случаях в семье или об измененном генотипе тщательно скрываются из-за страха быть “виновными”, если заболевание повторится.
Исследования показали, что в 80% супружеских пар, где оба супруга страдают нарушением слуха, рождаются нормально слышащие дети, и только 20% семей имеют глухих/тугоухих детей. Это связано со значительным разнообразием причин врожденной тугоухости, в том числе и генетических. Поэтому, у тех кто имеет нарушение слуха, но хочет родить ребенка с нормальным слухом есть выбор. В современных условиях определенную помощь в этом оказывает генетический анализ. В случае, если речь идет о нарушении слуха связанном с мутациями в гене коннексина 26, зная свои генотипы будущие родители могут точно знать, что будет ли у их детей нарушение слуха.
Важно помнить, что в случае рецессивной тугоухости передается не заболевание, передается измененный ген. Заболевание проявляется только в случае встречи двух измененных генов в генотипе человека. Если ребенку поставили диагноз наследственной тугоухости, это не значит, что всем его потомкам угрожает нарушение слуха.
Если два человека с рецессивным несиндромальным нарушением слуха (генотип аа), которое вызвано одним и тем же геном вступят в брак, все их дети будут страдать нарушением слуха, то есть риск в данном случае составит 100%. Внешне это будет выглядеть как повторение заболевания в семье.
Если человек с рецессивной формой несиндромальной тугоухости (генотип аа) вступит в брак с лицом, не являющимся носителем подобного гена (генотип АА), то нарушения слуха у детей этой пары не будет. Что же получается? Заболевание у одного из супругов наследственное, а повторения не произошло? Да, таковы законы генетики. В то же время, все, рожденные в такой паре дети, будут носителями измененного гена (генотип Аа). Эта ситуация характерна для слышащих детей в паре глухих родителей. Эти дети будут здоровы и не слудует опасаться развития у них нарушения слуха, по крайней мере, в следствие данной генетической причины.
В современных условиях в подобную ситуацию могут попасть дети с рецессивной несиндромальной формой нарушения слуха (генотип аа), прошедшие кохлеарную имплантацию, которые будут выбирать партнера в слышащей среде. То есть они могут рассчитывать на то, что в большинстве случаев среди здоровых людей они выберут партнера без изменений в гене коннексина 26. Но если они встретят здорового носителя такого же гена (генотип Аа), то в этом случае у них будет высокий риск рождения глухого ребенка – 50%. Только в случае такой встречи и попадания двух измененных генов в генотип ребенка заболевание повторится.
Человек, получивший только один ген, вызывающий рецессивное несиндромальное нарушение слуха (другой ген в паре нормальный – генотип Аа), не будет иметь нарушение слуха, так как рецессивный ген при наличии нормального гена в паре не проявляет своего действия. Но такой человек будет являться носителем и имеет риск рождения глухого ребенка при встрече с таким же носителем.
Если носитель мутации гена рецессивной тугоухости (генотип Аа) вступит в брак с лицом, не являющимся носителем патологически измененного гена (генотип АА), у них не будет детей с нарушением слуха, но каждый второй ребенок может оказаться носителем измененного варианта гена. Так ген будет передаваться не проявляя себя, пока не встретит себе пару.
В 80% случаев рецесивные мутации в гене коннексина 26 приводят к тяжелой врожденной сенсоневральной тугоухости или глухоте, которые эффективно реабилитируются с помощью метода кохлеарной имплантации. В 15% случаев встречается тугоухость III степени, в 5% случаев определяется тугоухость II степени. Последние требуют слухопротезирования, при этом дети учатся в массовой школе.
Нужно ли знать свой генотип?
Даже здоровому человеку желательно знать свой генотип, так как он может оказаться носителем распространенного изменения в одном из генов. Тем более, если у Вас есть родственники с нарушением слуха.
Консультирование призвано информировать семью о возможных исходах беременности. К сожалению, желание родителей иметь слышащего ребенка не всегда может осуществиться, и здесь неизбежны стрессовые ситуации. Знание генотипа помогает понять, на сколько это возможно в конкретной семье. Так, для семейной пары слышащих родителей, в которой оба являются носителями мутации 35delG возможна пренатальная диагностика (до 10-12 недели беременности). В любом случае независимо от результатов генетического тестирования семья распоряжается полученной ею информацией по своему усмотрению и может без страха смотреть в будущее.
Материал подготовила заведущий детским сурдологическим центром,
врач-сурдолог-оториноларинголог Фомина Т.И.
В связи с незрелостью позвоночного столба у новорожденного, в особенности с отсутствием окостенения задних элементов позвонков, ультразвуковое исследование является превосходным методом диагностики врожденных пороков развития спинного мозга в неонатальном периоде. Ультразвуковое исследование позволяет быстро и недорого обеспечить высококачественное изображение спинномозгового канала и является методом выбора для первоначальной оценки позвоночного столба при подозрении на пороки развития спинного мозга у новорожденного.
Болле подробно  Подозрение на пороки развития спинного мозга (УЗИ в педиатрии в клинической практике)
Подозрение на пороки развития спинного мозга (УЗИ в педиатрии в клинической практике)
Материал для врачей подготовлен врачом ультразвуковой диагностики Шишовой Л.В.
(статья из журнала Ультразвуковая диагностика. Практическое решение клинических проблем. Том 4 . УЗИ в педиатрии, 2011)
Классификация заболевания или состояния (группы заболеваний или состояний) часть1
В настоящее время для диагностики аутизма в России используется классификационная и диагностическая система МКБ-10 [1].
/F84.0/ Детский аутизм
Общее расстройство развития, определяющееся наличием аномального и/или нарушенного развития, которое проявляется в возрасте до 3 лет, и аномальным функционированием во всех трех сферах социального взаимодействия, общения и ограниченного, повторяющегося поведения.
У мальчиков расстройство развивается в 3-4 раза чаще, чем у девочек.
Диагностические указания: Предшествующего периода нормального развития обычно нет, но если есть, то аномалии выявляются в возрасте до 3 лет. Всегда отмечаются качественные нарушения социального взаимодействия. Они выступают в форме неадекватной оценки социо-эмоциональных сигналов, что заметно по отсутствию реакций на эмоции других людей и/или отсутствию модуляции поведения в соответствии с социальной ситуацией; плохо используются социальные сигналы и незначительна интеграция социального, эмоционального и коммуникативного поведения; особенно характерно отсутствие социо-эмоциональной взаимности.
Равным образом обязательны качественные нарушения в общении. Они выступают в форме отсутствия социального использования имеющихся речевых навыков; нарушений в ролевых и социально-имитационных играх; низкой синхронности и отсутствия взаимности в общении; недостаточной гибкости речевого выражения и относительного отсутствия творчества и фантазии в мышлении; отсутствия эмоциональной реакции на вербальные и 10 невербальные попытки других людей вступить в беседу; нарушенного использования тональностей и выразительности голоса для модуляции общения; такого же отсутствия сопровождающей жестикуляции, имеющей усилительное или вспомогательное значение при разговорной коммуникации.
Это состояние характеризуется также ограниченными, повторяющимися и стереотипными поведением, интересами и активностью. Это проявляется тенденцией устанавливать жесткий и раз и навсегда заведенный порядок во многих аспектах повседневной жизни, обычно это относится к новым видам деятельности, а также к старым привычкам и игровой активности.
Может наблюдаться особая привязанность к необычным, чаще жестким предметам, что наиболее характерно для раннего детского возраста. Дети могут настаивать на особом порядке выполнения ритуалов нефункционального характера; может иметь место стереотипная озабоченность датами, маршрутами или расписаниями; частыми являются моторные стереотипии; характерно проявление особого интереса к нефункциональным элементам предметов (таким как запах или осязательные качества поверхности); ребенок может противиться изменениям заведенного порядка или деталей его окружения (таких как украшения или меблировка дома).
Помимо этих специфических диагностических признаков дети с аутизмом часто обнаруживают ряд других неспецифических проблем, таких как страхи (фобии), нарушения сна и приема пищи, вспышки гнева и агрессивность.
Достаточно часты самоповреждения (например, в результате кусания запястий), особенно при сопутствующей тяжелой умственной отсталости.
Большинству детей с аутизмом не хватает спонтанности, инициативности и творчества в организации досуга, а при принятии решений им трудно использовать общие понятия (даже когда выполнение задач вполне соответствует их способностям).
Характерные для аутизма специфические проявления дефекта меняются по мере роста ребенка, но на протяжении зрелого возраста этот дефект сохраняется, проявляясь во многом сходным типом проблем социализации, общения и интересов.
Для постановки диагноза аномалии развития должны отмечаться в первые 3 года жизни, но сам синдром может диагностироваться во всех возрастных группах.
При аутизме могут быть любые уровни умственного развития, но примерно в трех четвертях случаев имеется отчетливая умственная отсталость.
Дифференциальный диагноз: Помимо других вариантов общего расстройства развития, важно учитывать:
специфическое расстройство развития рецептивной речи (F80.2) с вторичными социоэмоциональными проблемами;
реактивное расстройство привязанностей в детском возрасте (F94.1) или расстройство привязанностей в детском возрасте по расторможенному типу (F94.2);
умственную отсталость (F70 - F79) с некоторыми сопутствующими эмоциональными или поведенческими нарушениями;
шизофрению (F20.-) с необычно ранним началом;
синдром Ретта (F84.2).
F84.01 Детский аутизм, обусловленный органическим заболеванием головного мозга. Включаются: - аутистическое расстройство, обусловленное органическим заболеванием головного мозга.
F84.02 Детский аутизм вследствие других причин
Материал подготовила
зав. отделением медицинской психологии и лечебной педагогики, врач-психиатр Осмоловская Н.Е.
Мукополисахаридоз 2 (MПС2), или синдром Хантера – редкое рецессивное Х-сцепленное генетическое заболевание из группы лизосомных болезней накопления. МПС2 встречается с частотой 1:140 000– 1:156 000 живых новорожденных. В основном поражает мальчиков в раннем возрасте (3–4 года), но к настоящему времени описаны 7 случаев заболевания девочек. Синдром влияет на способность организма разрушать и перерабатывать определенные мукополисахариды, известные также как гликозаминогликаны (ГАГ). При синдроме Хантера ГАГ накапливаются в клетках организма из-за дефицита фермента индуронат-2-сульфатазы. Накопление ГАГ отрицательно сказывается на состоянии многих органов и тканей. Синдром Хантера – серьезное заболевание. Общие ранние симптомы синдрома Хантера могут включать в себя пупочные или паховые грыжи, ушные инфекции, насморк, проявления, сходные с проявлениями простуды. Поскольку эти симптомы довольно часто встречаются у всех новорожденных, маловероятно, что врач на ранних стадиях заболевания поставит диагноз или изначально предположит наличие синдрома Хантера. По мере накопления ГАГ в клетках организма признаки синдрома Хантера становятся более очевидными. Некоторые возможные более поздние признаки и симптомы:
- выпуклый лоб, плоский нос,
- увеличенный язык;
- задержка роста;
- большая голова;
- увеличенный живот;
- общие инфекции уха;
- респираторные заболевания;
- поражения печени и других внутренних органов:болезни сердца / клапанов сердца; проблемы с дыханием во сне, включая остановку дыхания и шумное дыхание в течение дня; ограниченная емкость легких;
- тугоподвижность суставов и ограниченный диапазон движения, что может привести к скованности при движении, ходьбе;
- кистевой - туннельный синдром;
- низкорослость;
- шероховатовая, «шагреневая» цвета слоновой кости кожа верхней части рук, ног и спины;
- заторможенное интеллектуальное развитие;
- нарушение сна;
- отсутствие аппетита, диарея.
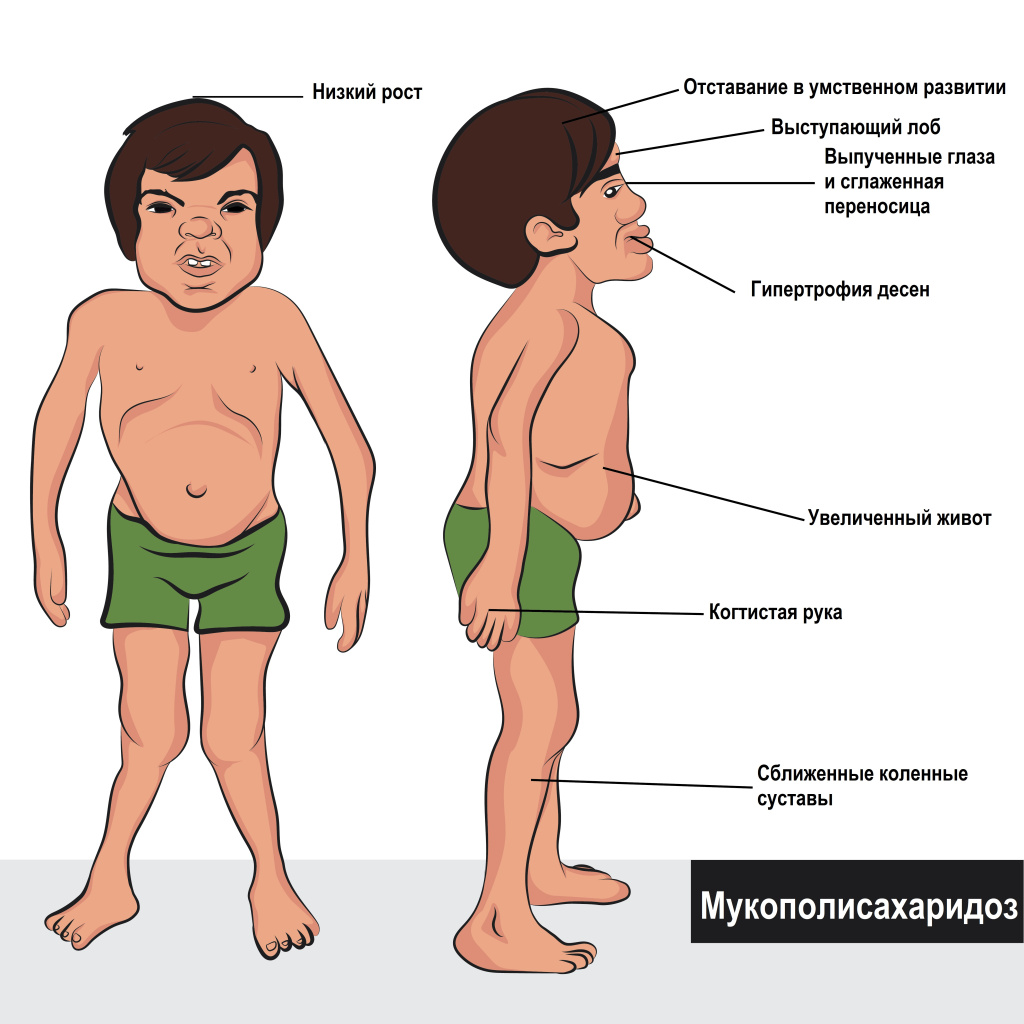
При подозрении на синдром Хантера рекомендуется провести генетический анализ. Диагноз генетического заболевания может быть поставлен на основе клинической картины; если внимательно изучить семейный анамнез, можно определить риск развития такой патологии. Генетический анализ может помочь обнаружить изменения в гене или хромосоме. Чаще всего на анализ берут кровь или образец ткани.
Причины, по которым может быть рекомендован генетический анализ:
- у одного из родителей есть ребенок с нарушениями или задержкой умственного развития или проблемами со здоровьем, предположительно связанными с генетическими причинами;
- диагностика у одного из родителей генетического заболевания;
- наличие генетического расстройства у одного из членов семьи;
- при проведении тестов на беременность (УЗИ, анализ мочи, анализ крови) выявлено, что существует повышенный риск рождения ребенка с генетическими и• выкидыш или преждевременные роды;
- наличие близких родственников с определенными видами рака.
Решение о проведении генетического анализа бывает трудным, его реализация полностью зависит от пациента. Результаты генетического анализа могут предоставить полезную информацию при планировании рождения ребенка. Если есть опасность, что у одного из родителей повышен риск рождения ребенка с генетическим заболеванием, возможно, есть необходимость обследовать плод во время беременности. Поскольку генетические заболевания возникают в разных ветвях семьи, информация о генетическом статусе пациента может быть полезной для всех ее членов. Нередко результаты анализа могут раскрыть семейные секреты, включая отцовство, материнство или усыновление. Тяжесть заболевания зависит от остаточной активности фермента. При тяжелых формах болезни с серьезными поражениями ожидаемая продолжительность жизни ограничена 10 или 12 годами. Пациенты с более легкими проявлениями генетического нарушения могут дожить до зрелого возраста. При своевременно назначенном специфическом лечении продолжительность жизни может достигать 40–50 лет. До введения ферментной заместительной терапии (ФЗТ) лечение МПС2 было паллиативным. До последнего времени на территории РФ было зарегистрировано 2 препарата, использующихся в ФЗТ: Идурсульфаза-β и Идурсульфаза. Применяется также симптоматическая и поддерживающая терапия. Такие проявления болезни, как грыжи и контрактуры суставов, лечат хирургическим путем. При гидроцефалии проводится хирургическая имплантация желудочкового шунта. Для улучшения слуха предписываются и индивидуально подбираются слуховые аппараты. Кроме того, постоянно проводятся физиотерапия, медицинские и генетические консультации. В России в настоящее время зарегистрировано более 100 пациентов с диагнозом синдрома Хантера и многие из них не получают необходимого лечения в силу его очень высокой стоимости. В 2018 г. прошел регистрацию новый препарат для лечения МПС2 – Хантераза. Он представляет собой очищенную форму лизосомального фермента идуронат-2-сульфатазы – рекомбинантной человеческой идуронат-2-сульфатазы. Идурсульфаза-β (Хантераза®, Green Cross Corp, Йонгъин, Южная Корея) – рекомбинантный белок, производимый с использованием методов генной инженерии из клеток яичников китайского хомячка. Идурсульфаза-β вырабатывается методом культивирования суспензии клеток.
Подготовила врач-невролог Котова О.С.
(Hydrotherapy) — педагогическое специфическое явление, сущность которого заключается в обучении и воспитании человека в условиях водной среды и средствами водной среды, с целью формирования качественно нового более высокого от исходного уровня физической и общественной активности человека с отклонением в состоянии здоровья. (Мосунов Д. Ф., 1998)[1].
Гидрореабилитация, — учебный предмет, изучает в образовательном учреждении явления, свойства и закономерности взаимоотношений человека и воды (сокращенно: воды с её физическими, химическими и биологическими соединениями).
Педагогическая гидрореабилитация (Pedagogical hydrorehabilitation), — учебный предмет, изучает в образовательном учреждении дидактические принципы, вытекающие из физических и общественных явлений, свойств и закономерностей взаимоотношений человека и воды, устанавливает порядок и последовательность деятельности педагога (или самостоятельную деятельность) направленную на формирование качественно нового более высокого от исходного уровня физической и общественной активности человека. Термин «гидрореабилитация», применяется в теории и методике физического воспитания, спортивной тренировке, адаптивной и оздоровительной физической культуре.
Впервые в гидрореабилитации установлено и введено понятие «взаимоотношение человека и воды» как специфическое органически целое общественное и физическое явление с его многообразными сторонами жизнедеятельности в условиях водной среды. Установлено и охарактеризовано субстанциальное свойство «взаимоотношений человека и воды» с её физическими, химическими и биологическими соединениями обеспечивать органически целое единение человека и воды в процессе оплодотворения, зарождения, формирования и жизни человека (Явление и субстанциальное свойство взаимоотношений человека и воды / М. Д. Мосунова; Д. Ф. Мосунов // Научно-теоретический журнал «Ученые записки университета имени П. Ф. Лесгафта», № 1 (83) — 2012 год. — С.117-123); DOI: 10.5930/issn.1994-4683.01.83.p117-123 Phenomenon and substantial feature of main-water interrelationship/Maria Dmitrievna Mosunova, Dmitry Fedorovich Mosunov.
Впервые термин «гидрореабилитация» как педагогическое направление научных исследований появляется по инициативе Российских ученых на международном симпозиуме «Biomechanics and medicine in swimming» (Finland, 1998). С тех пор гидрореабилитация включается в программы многих международных конференций, посвященных физической культуре, адаптивной физической культуре, спорту и здоровью. Гидрореабилитация, как учебная (с 2000 года) и научная (с 2002 года) дисциплина развивается в Российской Федерации учеными Национального государственного университета физической культуры, спорта и здоровья имени П. Ф. Лесгафта в Санкт-Петербурге на кафедре «Теории и методики гидрореабилитации»[2]. Здесь обобщается и анализируется накопленный многовековой опыт использования водной среды и её соединений в закономерностях, явлениях и свойствах взаимоотношений человека и воды.
Подготовил инструктор-методист по ЛФК Бредихин Н.С.
Своевременное овладение правильной, чистой речью имеет важное значение для формирования полноценной личности. Правильная, хорошо развитая речь является одним из основных показателей готовности ребенка к успешному обучению в школе. Недостатки речи могут привести к неуспеваемости, породить неуверенность малыша в своих силах, а это будет иметь далеко идущие негативные последствия. Поэтому начинать заботиться о правильности речи ребенка надо как можно раньше. К сожалению, количество детей с дефектами речи, в том числе и с нарушениями звукопроизношения, год от года не уменьшается, а растет.
Речь не является врожденной способностью, она формируется постепенно, и ее развитие зависит от многих причин. Одним из условий нормального становления звукопроизношения является полноценная работа артикуляционного аппарата.
Артикуляционная гимнастика — совокупность специальных упражнений, направленных на укрепление мышц артикуляционного аппарата, подвижности и дифференцированности движений органов, участвующих в речевом процессе.
Бытующее мнение о том, что звукопроизносительная сторона речи ребенка развивается самостоятельно, без специального воздействия и помощи взрослых — будто бы ребенок сам постепенно овладевает правильным произношением, глубоко ошибочно. Но именно оно часто является причиной того, что развитие звуковой стороны речи, особенно в раннем возрасте, происходит самотеком, без должного внимания со стороны родителей и воспитателей, и поэтому значительное число детей дошкольного возраста имеет те или другие недочеты произношения. А поскольку сами собой эти недостатки не исправляются, ежечасно мы слышим в той или иной мере дефектную речь, как детей, так и взрослых.
Невмешательство в процесс формирования детской речи почти всегда влечет за собой отставание в развитии. Дефекты звукопроизношения, возникнув и закрепившись в детстве, с большим трудом преодолеваются в последующие годы и могут сохраниться на всю жизнь. Компенсировать дефект может только квалифицированная помощь педагогов.
Воспитание чистой речи у детей дошкольного возраста — задача общественной значимости. Существует много средств устранения недостатков речи (игры, упражнения, артикуляционная гимнастика и другие). Артикуляционная гимнастика одна из них. Знакомство детей артикуляционной гимнастикой происходит с ранних лет. Благодаря артикуляционной гимнастике и упражнениям по развитию речевого слуха некоторые дети сами могут научиться говорить чисто и правильно. Артикуляционная гимнастика интересна своей яркой, доступной, понятной детям формой. Дети с интересом, восхищением пытаются подражать педагогу, повторить его действие. Повторяя вместе с педагогом упражнения, у детей развивается воображения, обогащается речь, эмоции.
Проблема: Одним из условий нормального становления звукопроизношения является полноценная работа артикуляционного аппарата. Чтобы ребенок научился произносить сложные звуки, его губы и язык должны быть сильными и гибкими, долго удерживать необходимое положение. Этому поможет научиться артикуляционная гимнастика.
Причины, по которым необходимо заниматься артикуляционной гимнастикой:
- Благодаря своевременным занятиям артикуляционной гимнастикой, некоторые дети сами могут научиться говорить чисто и правильно, без помощи логопеда.
- Дети со сложными нарушениями звукопроизношения смогут быстрее преодолеть свои речевые дефекты, когда с ними начнет заниматься логопед: их мышцы будут уже подготовлены.
- Артикуляционная гимнастика позволяет сократить сроки автоматизации звуков.
- Артикуляционная гимнастика очень полезна также детям с правильным, но вялым звукопроизношением.
- Занятия артикуляционной гимнастикой позволяет всем — и детям, и взрослым — научиться говорить правильно, четко и красиво.
Подготовила медицинский логопед Кузнецова В.С.
Одним из направлений коррекционной работы является нормализация и развитие голоса ребёнка. С этой целью проводится серия упражнений, которые направлены на вызывание более сильного голоса и на модуляции голоса по высоте и силе. Интересные упражнения можно заимствовать из работ Ермаковой И.И., Лопатиной Л.В., Л. И. Беляковой и других.
Работа над голосом всегда начинается с развития речевого дыхания, так как без сильной воздушной струи невозможно добиться нормального колебания голосовых складок.
Развитие дыхания можно начать с тренировки умения набирать как можно больше воздуха (как бы надуваем животик) и тренировки плавного долгого выдоха. Упражнение выполняется сначала в положении лёжа, а затем сидя и стоя. Ребёнка кладут на спину, на животике у ребёнка лежит лёгкая мягкая игрушка, и просят его надуть животик «как шарик», а затем «сдуть шарик», при этом игрушка поднимается и опускается. Когда ребёнок научится «качать игрушку на животике», ребёнка учат «надувать и сдувть животик» сидя и стоя, контролируя его движения рукой. Затем формируют у ребят длинный выдох, с этой целью можно дуть на пламя свечи или на специальные «фонтанчики».
Следующим этапов в развитии речевого дыхания может быть комплекс упражнений по методике «парадоксальной гимнастики А. Н. Стрельниковой». Данная гимнастика позволяет производить дальнейшее развитие грудо-брюшного типа дыхания, развитие подвижности диафрагмальной мышцы, увеличивать объем вдыхаемого воздуха.
Особое внимание обращается на следующие условия:
- активное внимание ребенка привлекается к фазе вдоха; тренировать только вдох: резкий, короткий, шумный. Выдох происходит после вдоха самостоятельно (через рот). Выдох не задерживать и не выталкивать. Вдох – очень активный через нос, выдох – через рот, не слышный и пассивный.
- вдох осуществляется в момент физической нагрузки;
- все упражнения проводятся в удобном, естественном для детей темпе и ритме.
Упражнения для коррекции нарушений голоса у детей с дизартрией
Детям можно предлагать следующие упражнения:
1. «Ладошки».
Встать прямо, руки согнуты в локтях (локтями вниз), а ладошки вперед – «поза экстрасенса». Стоя в этом положении, следует делать короткие, ритмичные, шумные вдохи через нос при этом сжимая ладони в кулачки (так называемые хватательные движения). Без паузы сделать 4 ритмичных, резких вдоха через нос. Потом руки опустить и отдохнуть 4-5 сек. Затем сделать еще 4 шумных, коротких вдоха и опять пауза.
2. «Погончики».
Выполняется стоя, руки сжаты в кулаки и прижаты к животу на уровне пояса. При вдохе необходимо резко толкнуть вниз к полу кулаки (плечи при этом не напрягать, руки выпрямлять до конца, тянувшись к полу. Затем вернуть кисти на уровень пояса в исходное положение. Сделать подряд 8 вдохов-движений.
3. «Насос».
Выполняется стоя, ноги немного уже, чем ширина плеч, руки внизу. Сделать легкий наклон (тянуться руками к полу, но не касаться) при этом во второй половине наклона делать короткий и шумный вдох через нос. Заканчивается вдох вместе с наклоном. Немного приподняться, но не полностью, и снова наклон+вдох. Можно представить, что ребёнок как будто накачивает шину в автомобиле. Наклоны выполняются легко и ритмично, низко наклонятся не стоит, достаточно наклониться до уровня пояса.
5. «Обними плечи».
Выполняется стоя, руки согнуты и подняты до уровня плеч. Необходимо очень сильно бросить руки, как будто хотите обнять себя за плечи. И с каждым движением делается вдох. Руки во время «объятия» должны быть параллельны по отношению друг к другу; очень широко в стороны разводить не стоит.
Следующий комплекс рассчитан на активизацию мускулатуры шеи, наружных и внутренних мышц гортани и подготовку голосового аппарата к фонации.
- исходное положение — руки в замок на затылке. Отклонение головы назад с легким сопротивлением рук;
- исходное положение — сжатые в кулак кисти упираются в подбородок. Наклоны головы вперед с легким сопротивлением рук;
- исходное положение — ладони рук прикрывают уши. Наклоны головы в стороны к плечам с сопротивлением рук;
- движение нижней челюсти вниз, в стороны, вперед. Сжимание челюстей;
- надувание щек;
- доставание кончиком языка мягкого нёба;
- поднятие мягкого нёба при зевке.
Голосовые упражнения
Следующим этапом коррекции являются голосовые упражнения для тренировки кинестезии и координации всех отделов речевого аппарата:
1. Произнесение звука [м] кратко при спокойном положении гортани, направляя звук так, чтобы он как бы «ударился» в твердое нёбо и вызвал большую резонацию вышележащих полостей. Когда данное упражнение не вызывает затруднений можно переходить к произнесению слогов ма, мо, мэ, мы…
2. Произнесение пар слогов с ударением на втором слоге: ма-ма, ма-мо, ма-му, ма-мэ, ма-мы; на-на, на-но, на-ну, на-нэ,на-ны.
ма-мо на-но
ма-му на-ну и т. д. и сочетания слогов с перемещающимися ударениями.
3. Произнесение закрытых слогов: мам, мом, мум, мэм, мым.
4. Произнести гласные звуки и их сочетания: а, ао, ау, аэ, аи, аоу, аоэ, аои, аоуэи, аоуи и т.д.
Закрепление сформированных голосовых навыков
Далее сформированные голосовые навыки закрепляются при тренировках всей просодической стороны речи. Детям можно предложить следующие упражнения:
1) Представьте, что вы заблудились в лесу. Вы стоите и кричите: «Ау-ау». Произносить звуки надо достаточно громко и четко.
2) Дети делятся на пары. Один из пары произносил фразы громким голосом, а партнёр отвечал тихо, словно эхо. Затем партнёры меняются местами. Для упражнения используются фразы из различных сказок.
3) Предлагаем детям как бы «шагать по ступенькам», произнося фразы «Первый этаж, второй этаж…седьмой этаж», постепенно повышая свой голос.
4) Детям предлагается прочитать текст: «На мели мы лениво налима ловили,/ Для меня вы ловили линя,/ О любви не меня ли вы мило молили/ И в туманы лиманы манили меня.» сначала высоким голосом, затем на характерной для них высоте, низким голосом и понижая голос от строчки к строчке.
5) Детям следует произнести скороговорку «Наш Полкан из Байкала лакал», выделяя по очереди каждое слово. Затем отдельным ребятам предлагаем ответить данной скороговоркой на вопросы:
Откуда лакал Полкан?
Чей Полкан из Байкала лакал?
Что делал Полкан?
На заключительном этапе коррекционной работы можно дать детям прочитать по ролям сказку или стихотворение, обращая их внимание на характеры героев и их интонации.
Представленные упражнения помогают развивать голосовые навыки у детей с нарушенной иннервацией мышц голосо-речевого аппарата, что при комплексной коррекционно-педагогической работе позволяет минимизировать проявления нарушений просодики у детей с дизартрией.
Подготовила медицинский логопед Селиверстова Н.В.
Для человека, который заикается, характерно говорить прерывисто, будто ему не хватает воздуха. Чтобы закончить фразу, ему приходится часто дышать, поэтому упражнения на дыхание крайне необходимы при лечении логоневроза.
В этом вопросе себя зарекомендовала гимнастика Стрельниковой. Комплекс включает в себя несколько упражнений, которые выполняются стоя, сидя или лежа. Во время занятий важно держать под строгим контролем каждый вдох и выдох — обращать внимание на интенсивность, глубину и частоту.
Что можно делать для коррекции:
- положить шарик из ваты на стол и сдувать его в разные стороны;
- лечь, разместить на животе какой-либо нетяжелый предмет и дышать, напрягая мышцы пресса;
- дуть мыльные пузыри, надувать воздушные шары;
- используя соломинку, делать в воде пузыри и др.
В гимнастике Стрельниковой есть очень эффективные упражнения «Насос» и «Кошка».
Первое предполагает наклон вниз из положения стоя, дотягиваясь руками до пола. При этом нужно громко вдыхая, будто втягивать что-то с пола.
«Кошка» же представляет собой приседания с поворотами тела вправо и влево в сопровождении шумных вдохов, которое будут имитировать кошачье фырканье. Выпрямляясь, следует спокойно выдыхать. Каждое из дыхательных упражнений требуется выполнять не менее 12 раз подряд.
Наследственная невропатия со склонностью к параличам от сдавления относится к редким аутосомно-доминантным заболеваниями, характеризующимся повышенной чувствительностью периферических нервов к сдавлению. Распространенность заболевания составляет 16 на 100 000 населения, но истинный показатель может быть выше в связи с трудностями распознавания данной патологии.
В большинстве случаев обнаруживается мутация на коротком плече 17 хромосомы в области гена, кодирующего PMP22. В отличие от наследственной полиневропатии 1А типа, при данном варианте выявляется не удвоение участка гена, а делеция, либо точечные мутации или вставки. Заболевание может проявиться в возрасте от 8 до 64 лет.
Возможно поражение любого периферического нерва, но чаще сдавлению подвергается малоберцовый нерв, лучевой нерв, локтевой нерв, срединный нерв. В 10% случаев больные обнаруживают парез после пробуждения. Парез часто сопровождается нарушениями чувствительности, но болевой синдром не характерен. Изредка поражаются черепные нервы. Эпизоды повреждения нервов имеют тенденцию к повторению.
На ЭНМГ выявляется фокальное замедление, блок проведения, временная дисперсия в одной или нескольких зонах компрессии.
Предложено несколько вариантов критериев ЭНМГ-диагностики данной невропаии. Verhagen W. и соавторы (1993) предложили для диагностики данного варианта НМСН выявить снижение скорости проведения по малоберцовому и локтевому нервам в сочетании с увеличением дистальной латентности при стимуляции малоберцового нерва.
Gouider R. с соавторами предложили в качестве критериев диагностики использовать двустороннее удлинение дистальной латентности при исследовании срединного нерва, нарушение проведения по сенсорным волокнам срединного нерва на уровне запястья и удлинение дистальной латенции или снижение скорости проведения при исследовании малоберцового нерва.
По материалам клинического руководства «Полиневропатии» О.С. Левин 2006 г.
Подготовила зав.центром нервно-мышечной патологии,
врач функциональной диагностики Симонова Е.Н.
Миотонии - группа генетически гетерогенных заболеваний ионных каналов хлора и натрия (каналопатии), характеризующиеся повышенной возбудимостью мембраны мышечных волокон, проявляющиеся миотоническими феноменами с постоянной или транзиторной слабостью скелетной мускулатуры. В современной классификации НМС представлены различными генетическими формами дистрофических (ДМ) и недистрофических миотоний (НДМ). Описаны точечные мутации генов хлорных каналов при врожденной аутосомно-доминантной миотонии Томсена и врожденной аутосомно-рецессивной миотонии Беккера, а также множество точечных мутаций вольтаж-зависимых натриевых каналов при врожденной (конгенитальной) парамиотонии (болезни Эйленбурга), семейном гиперкалиемическом периодическом параличе и др.
Дифференциальная диагностика НМС в ранней стадии до настоящего времени составляет проблему для клиницистов.
С помощью ЭМГ можно решить огромный круг вопросов, вызывающих затруднения у врача при клиническом осмотре больного и позволяющих исключить возможность ошибочной диагностики.
При диагностике миотонии и миотонических синдромов на первый план выходит не стимуляционная, а игольчатая ЭМГ, которая включает определение параметров потенциалов двигательных единиц (ПДЕ) и их формы (полифазии), выявление спонтанной активности мышечных волокон и двигательных единиц (ДЕ), анализ плотности мышечных волокон и джиттера. Стандартная игольчатая ЭМГ позволяет определять функциональное состояние мышцы, степень ее вовлечения в процесс, сохранность иннервации, степень денервации и эффективность реиннервации. Этот метод дает наибольшую информацию о состоянии периферического нейромоторного аппарата.
К электромиографической миотонической реакции относятся миотонические разряды (МР) — спонтанно возникающие разряды высокой частоты, характеризуемые прогрессирующим падением амплитуды потенциалов, их составляющих. Продолжительность разряда — от 1 с до 1 мин, однако столь длительные разряды редки. При прослушивании МР выявляется характерный звук «пикирующего бомбардировщика». Регистрируются МР при введении игольчатого электрода в мышцу, прикосновении к нему, постукивании по мышце, электростимуляции или при произвольном сокращении мышцы, но могут появляться и спонтанно. Миотонические разряды состоят из ПФ (потенциалов фасцикуляций) и/или ПОВ (положительных острых волн), которые имеют высокую частоту повторения (до 80-150 в секунду). Амплитуда и частота отдельных элементов быстро нарастают, а затем постепенно убывают. Исследователь, однажды услышавший этот характерный звук, в последующем может поставить диагноз скорее «ухом», чем «глазом», так как нередко приходится слышать разряды, которые не успели появиться на экране. На экране монитора МР выглядят как повторяющиеся потенциалы постепенно уменьшающейся амплитуды с прогрессивно увеличивающимися интервалами, что является причиной снижения высоты звука. Частота и интенсивность МР, отдельных ПФ и ПОВ при миотонии может быть увеличена длительным или поэтапным охлаждением исследуемой мышцы (например, при парамиотонии Эйленбурга) или согреванием (например, при дистрофической миотонии II типа). Кроме того, частота и амплитуда МР различны при отдельных формах миотонии. Например, при врожденной миотонии Томсена регистрируются короткие МР, во время которых амплитуда составляющих его ПФ и/или ПОВ падает, а частота нарастает. При парамиотонии Эйленбурга разряды провоцируются охлаждением и могут продолжаться несколько минут.
Характерная особенность миотонической задержки — ее уменьшение по мере повторения заданного усилия, что соответствует и уменьшению длительности судорожного сведения мышц. У пациентов с миотонией МР являются весьма стабильным проявлением патологического процесса и обнаруживаются не только в пораженных, но и в клинически интактных мышечных группах; МР могут быть также в мышцах родственников больных, страдающих миотонией, и служат признаком субклинической формы заболевания.
Наряду с МР, в мышцах больных миотонией иногда регистрируются и отдельные ПФ, фрагменты МР, состоящие из одиночных ПФ, например зарегистрированных в общем разгибателе пальцев. Потенциалы двигательных единиц (ПДЕ) при миотонии Томсена имеют нормальную длительность и амплитуду. При некоторых формах миотонических синдромов регистрируются псевдомиотонические разряды (ПМР) или «странные разряды высокой частоты». Происхождение этих разрядов до сих пор точно не известно. Большинство авторов считают их следствием эфаптической передачи возбуждения, эфаптической реактивации пейсмеккера, запускаемого одним из волокон, участвующих в разряде.
Наиболее часто ПМР выявляются при полимиозите, прогрессирующей мышечной дистрофии, травмах или компрессии нерва, невральной амиотрофии и ряде других заболеваний. Их продолжительность может быть от нескольких секунд до 10 мин и более. Они характеризуются стабильностью амплитуды потенциалов на всем протяжении разряда.
При проведении стимуляционной ЭМГ у больных с миотониями величины латенции и скорость распространения возбуждения (СРВ) не нарушены.
Таким образом, миотония и миотонические синдромы намного чаще встречаются, чем диагностируются.
По материалам статей «Клинико‑электромиографические критерии диагностики наследственных миотонических синдромов» (В. П. Федотов, С. А. Курбатов, Е. А. Иванова, Н. М. Галеева, А. В. Поляков). Журнал «Нервно-мышечные болезни» № 3 за 2012 г. и «Клинико-диагностические критерии миотонии» Н. А. Шнайдер (журнал «Сибирское медицинское обозрение» №3 за 2016)
Подготовила зав.центром нервно-мышечной патологии,
врач функциональной диагностики Симонова Е.Н.
Двигательная единица (ДЕ) включает в себя альфа-мотонейрон и иннервируемый им пул мышечных волокон. Войдя в мышцу, аксон мотонейрона разветвляется на дендриты, каждый из которых иннервирует отдельное мышечное волокно. Таким образом, один мотонейрон иннервирует достаточно большое количество мышечных волокон (от нескольких единиц до нескольких тысяч), в то время как каждое мышечное волокно иннервируется только одним двигательным нейроном.
Установлено, что мышечные волокна, принадлежащие к одной ДЕ, рассредоточены по всей мышце, то есть принадлежат к разным мышечным пучкам. Такое рассредоточенное распределение мышечных волокон каждой ДЕ обеспечивает равномерное сокращение мышцы, когда в работу «включается» лишь некоторая часть ДЕ.
Существуют различные классификации ДЕ. Исходя из значимости для организма, Р. Берк с соавт. (R.E. Burke, 1973) предложил разделять ДЕ по сочетанию двух признаков – скорости сокращения и устойчивости к утомлению. По этой классификации ДЕ делятся на три типа: S (slow) – медленные, устойчивые к утомлению; FR (fast resistant) – быстрые, устойчивые к утомлению, FF (fast fatigable) – быстрые, быстроутомляемые. Этим ДЕ соответствуют различные типы мышечных волокон.
Строение и функции мотонейрона соответствуют морфологическим характеристикам мышечных волокон, которые он иннервирует. Так, мотонейрон ДЕ S типа имеет небольшое клеточное тело и иннервирует от 10 до 180 мышечных волокон, а мотонейрон ДЕ FF типа имеет большое клеточное тело и иннервирует от 300 до 800 мышечных волокон (Дж.Х. Уилмор, Д.Л. Костилл, 1997).
ДЕ S типа имеют низкий порог активации, поэтому при развитии силы мышцы они включаются в работу первыми. После этого активируются ДЕ FR типа. ДЕ FF типа обладают высоким порогом активации, поэтому при развитии усилия в мышце они активируются последними.
Благодаря тому, что мышечные волокна, принадлежащие различным ДЕ, рассредоточены по всей мышце, а не находятся в одном пучке, развитие силы мышцы характеризуется плавностью.
Как функциональное ключевое звено нервно-мышечной системы двигательная единица является основным объектом изучения в электромиографии. Потенциал двигательной единицы (ПДЕ) – это суммарный потенциал активности мышечных волокон, принадлежащих одной двигательной единице. Произвольное напряжение мышцы позволяет четко регистрировать одиночные потенциалы двигательных единиц в том случае, если кончик электрода находится в непосредственной близости к концевой пластинке мышечных волокон.
Основными параметрами ПДЕ являются амплитуда, длительность, степень полифазии. Проводится анализ как каждого ПДЕ, так и статистический анализ 20-ти разных ПДЕ, зарегистрированных в разных участках одной мышцы
ДЕ обладает функциональной целостностью, и поражение одного отдела приводит к компенсаторным или патологическим изменениям в остальных отделах ДЕ, что отражается на показателях игольчатой ЭМГ.
При патологии ДЕ на любом уровне происходит ее функциональная перестройка, что приводит к изменению параметров ПДЕ. Это находит свое отражение в ЭМГ-стадиях денервационно-реиннервационного процесса.
Комплексный анализ электрической активности мышцы позволяет выявить характер компенсаторных изменений в мышце в результате патологического процесса. Перестройка структуры ДЕ не имеет нозологической специфичности, но достаточно точно отражает уровень поражения отделов ДЕ: мышечный, аксональный, нейрональный.
По материалам сайтов
Подготовила зав.центром нервно-мышечной патологии,
врач функциональной диагностики Симонова Е.Н.
УЗ-исследование коленного, голеностопного суставов и стопы
Материал подготовлен врачом ультразвуковой диагностики Шишовой Л.В.
(по материалам статьи Рональда Адлера "Ультразвуковое исследование коленного, голеностопного суставов и стопы")
Кардиологический скрининг — это комплекс исследований новорождённых детей, направленных на раннее выявление патологий сердечно-сосудистой системы, в том числе врождённых пороков сердца (ВПС). В настоящее время, ВПС занимают лидирующие позиции по распространённости в сравнении с другими пороками развития у детей и остаются ведущей причиной их смерти. Более того, прогнозируется дальнейший рост распространённости ВПС. Отчасти это может быть обусловлено совершенствованием диагностических методик, связанных с увеличением квалификации специалистов ультразвуковой диагностики и улучшением визуализирующих техник. По разным данным, показатели распространённости ВПС у детей значительно варьируют и составляют от 4 до 50 случаев на 1000 живорождённых. Такая вариабельность объясняется разницей в критериях их оценки. В частности, распространённость патологии увеличивается при учёте детей с малыми ВПС (например, малым открытым артериальным протоком). В структуре сердечно-сосудистой патологии в Российской Федерации доля ВПС составляет около 16% и колеблется на уровне 30% у детей в возрасте до 13 лет. Понятие «критический порок сердца» применяется для обозначения ВПС, сопровождающихся развитием критических состояний в ближайшие часы или сутки после рождения. Это такие состояния, как острый дефицит сердечного выброса, быстрое прогрессирование сердечной недостаточности, кислородное голодание тканей с развитием декомпенсированного метаболического ацидоза и нарушением функций жизненно важных органов.
К критическим порокам относятся:
-
транспозиция магистральных артерий (ТМА)
-
коарктация аорты
-
критический клапанный стеноз легочной артерии
-
перерыв дуги аорты
-
тетрада Фалло
-
общий артериальный ствол (ОАС)
-
тотальный аномальный дренаж легочных вен (ТАДЛВ)
-
атрезия легочной артерии (АЛА) с интактной межжелудочковой перегородкой
-
критический клапанный стеноз аорты
-
синдром гипоплазии левых отделов сердца
Частота встречаемости обсуждаемых ВПС в первые 28 дней жизни составляет от 20 до 30%. Более 70% детей с критическим ВПС при своевременной диагностике и адекватном лечении могут быть спасены, а качество их жизни улучшено, в том числе, благодаря кардиологическому скринингу новорожденных. Как проводится кардиологический скрининг новорождённых, какие сроки назначения скрининга и этапы проведения исследования Раннюю диагностику врождённых пороков сердца можно условно разделить на 2 этапа (антенатальную и постнатальную).
1 этап (антенатальный): в соответствие с Приказом от 20 октября 2020 г. № 1130н «Порядок оказания медицинской помощи по профилю «Акушерство и гинекология», всем беременным женщинам при сроках беременности 11–14 и 19–21 неделя проводится ультразвуковое исследование плода с целью выявления пороков развития плода, в том числе врождённых пороков сердца.
2 этап (постанальный): программа скрининга новорождённых, которая также делится на 3 этапа и проводится непосредственно в родильном доме.
Что включает кардиологический скрининг новорожденных в родильном доме:
1 этап Картиологический скрининг новорожденных в родильном доме проводится сразу после рождения (в родильном зале) всем детям. Он включает в себя такие рутинные методы, как:
- осмотр и оценка цвета кожных покровов
- пульсоксиметрия на правой руке и любой ноге
- оценка пульсации периферических артерий на всех конечностях
- аускультация сердца с подсчетом частоты сердечных сокращений
2 этап Если в результате первичного осмотра будет обнаружен хотя бы один из перечисленных ниже патологических признаков:
- центральный цианоз с показателями пульсоксиметрии на руке <90%, цианозом нижних конечностей или дифференцированным (асиметричным) цианозом
- признаки сниженного системного кровообращения: низкое наполнение пульса на артериях правой руки и/или ног, похолодание конечностей, слабое наполнение капиллярного русла кончиков пальцев, бледность/серость кожных покровов, снижение диуреза, угнетение ЦНС
- шумы при аускультации сердца
- тахикардия (>180 ударов в минуту) или брадикардия (<100 ударов в минуту), а также признаки аритмии, то ребёнку требуется проведение 2 этапа кардиологического скрининга, а именно на фоне проведения первичной реанимационной помощи по общему стандарту, максимально ранняя консультация кардиолога, кардиохирурга (возможно дистанционно), диагностика и коррекция возможных осложнений и пороков со стороны других органов и систем, генетическое обследование.
3 этап Учитывая гемодинамические особенности критических ВПС рекомендовано провести 3 этап кардиологического скрининга новорожденных в родильном доме на 3-4 сутки жизни младенцам, находящимся в группе риска по развитию сердечно-сосудистой патологии.
Скрининг на ВПС у новорожденного состоит из следующих методов:
- оценка цвета кожных покровов
- аускультация сердца и легких
- измерение артериального давления на правой руке и любой ноге
- пульсоксиметрия на правой руке и любой ноге (желательно одномоментная)
- подсчет частоты дыхания и оценка его характеристик
- электрокардиография
- оценка расположения сердца в грудной полости и печени в брюшной полости
- оценка наличия синдромальной патологии и других врожденных дефектов развития
Результаты скрининга сердца у новорожденных и дальнейшая тактика ведения в случае выявления патологии сердечно-сосудистой системы
Если при проведении скрининга у ребёнка все показатели в нормальных референсных значениях, то результат кардиологического скрининга новорождённых — отрицательный. При проведении скрининга ВПС у новорождённого в родильном доме могут быть выявлены следующие отклонения, являющиеся основанием для неотложного консультирования кардиологом:
- центральный цианоз или серость кожных покровов
- отсутствие или значительное ослабление пульсации артерий конечностей, олигурия
- снижение систолического АД на нижних конечностях на 10 мм рт.ст и более, по сравнению с АД на правой руке
- превышения показателя насыщения крови кислородом по данным пульсоксиметрии на правой руке на 5 % и выше в сравнении с показателями на ноге
- тахипноэ выше 60 в минуту с элементами дыхательного дистресса
- увеличение печени (нижний край печени более, чем на 2 см выступает из-под края реберной дуги)
- тахикардия (>180 ударов в минуту) или брадикардия (<100 ударов в минуту), сердечная аритмия
- шумы в сердце.
При наличии хотя бы одного из вышеперечисленных признаков ребёнка (положительный результата) следует срочно перевести в специализированный стационар второго этапа медицинских организаций, имеющий в своей структуре кардиологические или кардиохирургические койки. В случае невозможности перевода в такое отделение необходима консультация ребёнка врачом-детским кардиологом.
Подготовила зав. Центром раннего вмешательства, врач-педиатр Корнилова И.Ю.